אבנדיה לטיפול בסוכרת
שם מותג: AVANDIA
שם גנרי: רוזיגליטאזון maleate
תוכן:
אינדיקציות ושימוש
מינון ומינהל
טפסי מינון וחומרות
התוויות נגד
אזהרות ואמצעי זהירות
תגובות שליליות
אינטראקציות סמים
שימוש באוכלוסיות ספציפיות
מינון יתר
תיאור
פרמקולוגיה קלינית
טוקסיקולוגיה לא קלינית
מחקרים קליניים
כמה מסופק
אבנדיה, רוזיגליטאזון מליאט, מידע על מטופלים (באנגלית פשוטה)
אזהרה
כישלון לב קוגסטטיבי ואיסכמיה שריר הלב
- תיאאזולידינדיונים, כולל רוזיגליטאזון, גורמים או מחמירים אי ספיקת לב גודש אצל חלק מהמטופלים [ראה אזהרות ואמצעי זהירות]. לאחר התחלת AVANDIA, ואחרי שהעלייה במינון, יש לבדוק את המטופלים בזהירות אחר סימנים ותסמינים של אי ספיקת לב (כולל עלייה מהירה, מהירה במשקל, דיספנאה ו / או בצקת). אם מתפתחים סימנים ותסמינים אלה, יש לנהל את אי ספיקת הלב בהתאם לסטנדרטים המקובלים בטיפול. יתר על כן, יש לשקול הפסקת או הפחתת המינון של AVANDIA.
- AVANDIA אינה מומלצת בחולים עם אי ספיקת לב סימפטומטית. התווית AVANDIA בקרב חולים עם אי ספיקת לב NYHA Class III או IV הינה התווית. [ראה התוויות נגד ו אזהרות ואמצעי זהירות.]
- מטה-אנליזה של 42 מחקרים קליניים (משך ממוצע של 6 חודשים; 14,237 חולים בסך הכל), שרובם השוו בין AVANDIA לפלסבו, הראו כי AVANDIA היה קשור לסיכון מוגבר לאירועים איסכמיים בשריר הלב כמו תעוקת לב או אוטם שריר הלב. שלושה מחקרים אחרים (משך ממוצע 41 חודשים; 14,067 חולים בסך הכל), בהשוואה בין AVANDIA לכמה תרופות נגד סוכרת אוראלית או פלסבו שאושרו, לא אישרו או שללו סיכון זה. במלואם, הנתונים הזמינים על הסיכון לאיסכמיה של שריר הלב אינם חד משמעיים. [ראה אזהרות ואמצעי זהירות.]
חלק עליון
אינדיקציות ושימוש
טיפול במונותרפיה ושילוב
AVANDIA מצוין כתוספת לדיאטה ופעילות גופנית לשיפור השליטה הגליקמית בקרב מבוגרים הסובלים מסוכרת מסוג 2.
מגבלות שימוש חשובות
- בשל מנגנון הפעולה שלו, AVANDIA פעיל רק בנוכחות אינסולין אנדוגני. לפיכך, אין להשתמש ב AVANDIA בחולים עם סוכרת מסוג 1 או לטיפול בקיטואידוזיס סוכרתית.
- הטיפול המתן יחד עם AVANDIA ואינסולין אינו מומלץ.
- השימוש ב- AVANDIA עם חנקות אינו מומלץ.
חלק עליון
מינון ומינהל
יש להתאים באופן אישי את הטיפול בטיפול נגד סוכרת. על כל החולים להתחיל AVANDIA במינון המומלץ ביותר. עלייה נוספת במינון ה- AVANDIA צריכה להיות מלווה במעקב קפדני אחר תופעות לוואי הקשורות לאגירת נוזלים [ראה אזהרת קופסא ו אזהרות ואמצעי זהירות].
ניתן להעניק AVANDIA במינון התחלתי של 4 מ"ג, כמנה יומית יחידה או בשתי מנות מחולקות. לחולים המגיבים בצורה לא מספקת לאחר 8 עד 12 שבועות של טיפול, כפי שנקבע על ידי הפחתה בצום הגלוקוז בצום (FPG), ניתן להגדיל את המינון ל -8 מ"ג ביום כמונתרפיה או בשילוב עם metformin, sulfonylurea, או sulfonylurea plus מטפורמין. הפחתות בפרמטרים גליקמיים לפי מינון ומשטר מתוארות תחת מחקרים קליניים. AVANDIA ניתן ליטול עם או בלי אוכל.
המינון היומי הכולל של AVANDIA לא יעלה על 8 מ"ג.
טיפול במונותרפיה
מינון ההתחלה הרגיל של AVANDIA הוא 4 מ"ג הניתנים כמנה אחת פעם ביום או במנות מחולקות פעמיים ביום. במחקרים קליניים, המשטר של 4 מ"ג פעמיים ביום היה הביא להפחתה הגדולה ביותר ב- FPG ובהמוגלובין A1c (HbA1c).
שילוב עם Sulfonylurea או Metformin
כאשר מתווספים AVANDIA לטיפול קיים, ניתן להמשיך את המינון / ים הנוכחיים של הסוכן / ים לאחר תחילת הטיפול עם AVANDIA.
Sulfonylurea: כאשר משתמשים בשילוב עם סולפונילוריאה, מינון ההתחלה הרגיל של AVANDIA הוא 4 מ"ג הניתנים כמנה אחת פעם ביום או במנות מחולקות פעמיים ביום. אם חולים מדווחים על היפוגליקמיה, יש להוריד את מינון הסולפונילוריאה.
מטפורמין: מינון ההתחלה הרגיל של AVANDIA בשילוב עם מטפורמין הוא 4 מ"ג הניתנים כמנה אחת פעם ביום או במנות מחולקות פעמיים ביום. אין זה סביר שמינון המטפורמין ידרוש התאמה כתוצאה מהיפוגליקמיה במהלך טיפול משולב עם AVANDIA.
שילוב עם Sulfonylurea Plus Metformin
מינון ההתחלה הרגיל של AVANDIA בשילוב עם סולפונילוריאה בתוספת מטפורמין הוא 4 מ"ג הניתנים כמנה אחת פעם ביום או כמינונים מחולקים פעמיים ביום. אם חולים מדווחים על היפוגליקמיה, יש להוריד את מינון הסולפונילוריאה.
אוכלוסיות חולים ספציפיות
ליקוי כלייתי: אין צורך בהתאמת מינון כאשר AVANDIA משמשת כטיפול יחידתי בחולים עם לקות כליות. מכיוון שמטפורמין אינו מהווה התווית נגד חולים כאלה, מתן מתכוון של מטפורמין ו- AVANDIA הוא גם התווית נגד חולים עם לקות כליות.
ספיקת כבד: יש למדוד אנזימי כבד לפני תחילת הטיפול ב- AVANDIA. אין להתחיל טיפול באמצעות AVANDIA אם המטופל מגלה הוכחות קליניות לפעילות מחלת כבד או עלייה ברמת הטרנסמינז סרום (ALT> 2.5X הגבול העליון של הנורמלי בתחילת טיפול). לאחר התחלת AVANDIA יש לעקוב מדי פעם אחר אנזימי הכבד לפי שיקול דעתו הקליני של איש המקצוע הבריאותי. [ראה אזהרות ואמצעי זהירות ו פרמקולוגיה קלינית.]
ילדים: אין די נתונים בכדי להמליץ על שימוש בילדים באבנדיה [ראה שימוש באוכלוסיות ספציפיות].
חלק עליון
צורות מינון וחוזקות
טבלית TILTAB מצופה סרט מחומש מכילה רוזיגליטאזון כמלאט כדלקמן:
- 2 מ"ג - ורוד, מובלט עם SB בצד אחד ו -2 בצד השני
- 4 מ"ג - כתום, מובלט עם SB בצד אחד ו -4 מצד שני
- 8 מ"ג - אדום-חום, מובלט עם SB בצד אחד ו -8 בצד השני
חלק עליון
התוויות נגד
התווית AVANDIA בקרב חולים עם איגוד הלב הקים בניו יורק (NYHA) בכיתה III או IV היא התווית נגד [ראו אזהרה קופסת].
חלק עליון
אזהרות ואמצעי זהירות
כשל לב
AVANDIA, כמו תיאזולידינדיונים אחרים, לבד או בשילוב עם תרופות אנטי-סוכרתיות אחרות, יכול לגרום לאגירת נוזלים העלולים להחמיר או להוביל לאי ספיקת לב. יש להקפיד על חולים בסימנים ותסמינים של אי ספיקת לב. אם מתפתחים סימנים ותסמינים אלה, יש לנהל את אי ספיקת הלב בהתאם לסטנדרטים המקובלים בטיפול. יתרה מזאת, יש לשקול הפסקת או הפחתת המינון של רוזיגליטאזון [ראה אזהרה קופסת].
לחולים עם אי ספיקת לב (CHF) NYHA Class I ו- II שטופלו באבניה יש סיכון מוגבר לאירועים קרדיווסקולריים. מחקר של שבוע-עברו, מבוקר פלצבו מבוקר פלסבו, שנערך 52 שבועות, נערך ב 224 חולים עם סוג 2 סוכרת ו- CHF מחלת IHA מסוג I או II (חלקיקי פליטה - 45%) על רקע נגד סוכרת ו- CHF טיפול. ועדה עצמאית ערכה הערכה מסנוורת של אירועים הקשורים לנוזל (כולל אי ספיקת לב) ואשפוזים קרדיווסקולריים על פי קריטריונים מוגדרים מראש (שיפוט). החוקרים דיווחו על תופעות לוואי אחרות של הלב וכלי הדם בנפרד מהשיקול. למרות שלא נצפתה הבדל בטיפול בשינוי משורת המוצא של שברים פליטה, יותר תופעות לוואי קרדיווסקולריות נצפו לאחר טיפול ב- AVANDIA בהשוואה לפלסבו במהלך הטיפול מחקר בן 52 שבועות. (ראה טבלה 1)
שולחן 1. תופעות לוואי קרדיווסקולריות מתפתחות אצל חולים עם אי ספיקת לב (NYHA מחלקה I ו- II) שטופלו באבנדיה או פלסבו (בנוסף לטיפול בתרופות נגד סוכרת ו- CHF).
| אירועים | אבנדיה N = 110 n (%) |
תרופת דמה N = 114 n (%) |
| נפסק | ||
| מקרי מוות קרדיווסקולריים | 5 (5%) | 4 (4%) |
| החמרת CHF | 7 (6%) | 4 (4%) |
| - עם אשפוז לילה | 5 (5%) | 4 (4%) |
| - ללא אשפוז בן לילה | 2 (2%) | 0 (0%) |
| בצקת חדשה או מחמירה | 28 (25%) | 10 (9%) |
| דיספנאה חדשה או מחמירה | 29 (26%) | 19 (17%) |
| עליות בתרופות ל- CHF | 36 (33%) | 20 (18%) |
| אשפוז לב וכלי דם * | 21 (19%) | 15 (13%) |
| דיווח החוקרים, לא שפוט | ||
| תופעות לוואי איסכמיות | 10 (9%) | 5 (4%) |
| - אוטם שריר הלב | 5 (5%) | 2 (2%) |
| - אנגינה | 6 (5%) | 3 (3%) |
| * כולל אשפוז מכל סיבה שהיא לב וכלי דם. |
התווית AVANDIA בקרב חולים עם אי ספיקת לב NYHA Class III או IV הינה התווית. AVANDIA אינה מומלצת בחולים עם אי ספיקת לב סימפטומטית. [ראה אזהרה קופסת.]
חולים הסובלים מתסמונות כליליות חריפות לא נבדקו במחקרים קליניים מבוקרים. לאור הפוטנציאל להתפתחות של אי ספיקת לב בקרב חולים עם אירוע כלילי חריף, התחלת AVANDIA אינה מומלץ לחולים הסובלים מאירוע כלילי חריף, ויש להפסיק את AVANDIA בשלב אקוטי זה נחשב.
חולים עם מצב לבבי של NYHA בדרגה III ו- IV (עם CHF או בלעדיו) לא נבדקו במחקרים קליניים מבוקרים. AVANDIA אינה מומלצת בחולים עם מצב לבבי NYHA Class III ו- IV.
איסכמיה שריר הלב
מטה-ניתוח של איסכמיה שריר הלב בקבוצה של 42 ניסויים קליניים
מטה אנליזה נערכה בדיעבד כדי להעריך תופעות לוואי קרדיווסקולריות שדווחו על 42 מחקרים קליניים אקראיים מבוקרים כפול-סמיות (משך ממוצע של 6 חודשים).1
מחקרים אלה נערכו בכדי להעריך את יעילות הורדת הגלוקוז בסוכרת מסוג 2, ושיקול דעת מתוכנן מראש של אירועים קרדיווסקולריים לא התרחש בניסויים. חלק מהניסויים היו בשליטת פלצבו וחלקם השתמשו בתרופות פעולות נגד סוכרת אוראלית כבקרות. מחקרים מבוקרים בפלצבו כללו ניסויים חד-פעמיים (מונותרפיה עם AVANDIA לעומת מונותרפיה פלצבו) ובדיקות תוספות (AVANDIA או פלצבו, שנוספו לסולפונילוריאה, מטפורמין או אינסולין). מחקרי בקרה פעילים כללו ניסויים חד-פעמיים (מונותרפיה עם AVANDIA לעומת סולפונילוריאה או מטפורמין) מחלות מונותרפיה) ובדיקות תוספות (AVANDIA פלוס סולפונילוריאה או AVANDIA פלוס מטפורמין, לעומת סולפונילוריאה פלוס מטפורמין). בסך הכל נכללו 14,237 חולים (8,604 בקבוצות טיפוליות המכילות AVANDIA, 5,633 בקרב קבוצות משווה), עם 4,143 חשיפות שנות חולה לאבנדיה ו -2,675 שנות חשיפה לחולים ל משווה. אירועים איסכמיים בשריר הלב כללו אנגינה פקטוריס, אנגינה פקטריס מחמירה, תעוקת לב לא יציבה, דום לב, כאבים בחזה, כלילית חסימה בעורקים, דיספנאה, אוטם שריר הלב, פקקת כלילית, איסכמיה שריר הלב, מחלת עורקים כלילית ועורק כלילי. הפרעה. בניתוח זה, סיכון מוגבר לאיסכמיה של שריר הלב עם AVANDIA לעומת משווים משולבים נצפתה (2% AVANDIA לעומת 1.5% משווים, יחס הסיכויים 1.4, 95% רווח סמך [CI] 1.1, 1.8). בסיכון מוגבר לאירועים איסכמיים של שריר הלב עם AVANDIA נצפתה במחקרים ששלטו על פלצבו, אך לא במחקרים שנשלטו באופן פעיל. (ראה איור 1)
סיכון מוגבר גדול יותר לאירועים איסכמיים בשריר הלב נצפתה במחקרים בהם נוספה AVANDIA לאינסולין (2.8% עבור AVANDIA פלוס אינסולין לעומת 1.4% לפלסבו פלוס אינסולין, [OR 2.1, 95% CI 0.9, 5.1]). סיכון מוגבר זה משקף הפרש של 3 אירועים ל 100 שנות חולה (95% CI -0.1, 6.3) בין קבוצות הטיפול. [ראה אזהרות ואמצעי זהירות.]
איור 1. עלילת יערות ביחסי הסיכויים (95% אינטרוולים של ביטחון) לאירועים איסכמיים של שריר הלב במטא-אנליזה של 42 ניסויים קליניים
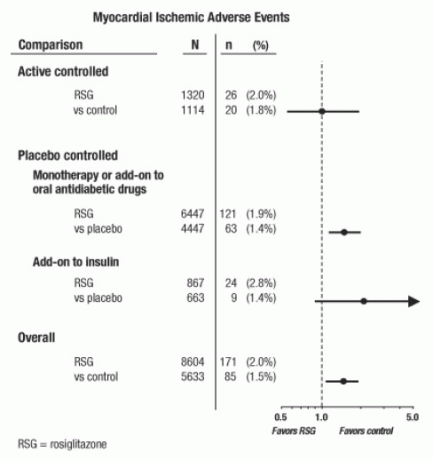
סיכון מוגבר גדול יותר לאיסכמיה של שריר הלב נצפה גם בקרב חולים שקיבלו טיפול AVANDIA וניטראט ברקע. עבור AVANDIA (N = 361) לעומת בקרה (N = 244) בקרב משתמשי החנקה, יחס הסיכויים היה 2.9 (95% CI 1.4, 5.9), ואילו בקרב משתמשים שאינם חנקתיים (כ -14,000 חולים בסך הכל), יחס הסיכויים היה 1.3 (95% CI 0.9, 1.7). סיכון מוגבר זה מייצג הבדל של 12 אירועים איסכמיים שריר הלב לכל 100 שנות חולה (95% CI 3.3, 21.4). מרבית המשתמשים בחנקה חלו במחלות לב כליליות. בקרב חולים עם מחלת לב כלילית ידועה שלא טיפלו בניטראט, לא הוכח סיכון מוגבר לאירועים איסכמיים של שריר הלב אצל AVANDIA לעומת משווה.
אירועים איסכמיים של שריר הלב במחקרים מבוקרים אקראיים ארוכי טווח של ניסויים מבוקרים אקראיים של AVANDIA
נתונים משלושה מחקרים קליניים גדולים אחרים, ארוכי טווח, פרוספקטיביים, אקראיים ומבוקרים של AVANDIA הוערכו בנפרד מהמטה-אנליזה. שלושת הניסויים הללו כוללים סך של 14,067 חולים (קבוצות טיפול המכילות AVANDIA N = 6,311, משווה קבוצות N = 7,756), עם חשיפה לשנת מטופל של 21,803 שנות חולה עבור AVANDIA ו -25,998 שנות חולה במשך משווה. משך המעקב חורג משלוש שנים בכל מחקר. ADOPT (ניסוי התקדמות תוצאות סוכרת) היה מחקר אקראי של 4-6 שנים, מבוקר פעיל, בקרב מטופלים שאובחנו לאחרונה עם סוכרת מסוג 2 שעדיין לא טיפלו בתרופות.
זה היה ניסוי יעילות ובטיחות כללית שנועדה לבחון את עמידותו של
AVANDIA כמונותרפיה (N = 1,456) לבקרה גליקמית בסוכרת מסוג 2, עם זרועות משווה של מונותרפיה סולפונילוריאה (N = 1,441) ומטותרפיה עם מטפורמין (N = 1,454). DREAM (הערכת הפחתת סוכרת עם תרופת רוזיגליטזון ורמיפריל, פורסם דו"ח 2) הייתה 3- ל מחקר אקראי, מבוקר פלסבו, בן 5 שנים, בקרב חולים עם סובלנות לגלוקוז לקויה ו / או לקויים בצום גלוקוזה. היה לו תכנון מפעל 2X2, שנועד להעריך את ההשפעה של AVANDIA, ובנפרד של ראמיפריל (מעכב אנגיוטנסין המרה אנזים [ACEI]), על התקדמות לסוכרת גלויה. ב- DREAM, 2,635 חולים היו בקבוצות טיפול המכילות AVANDIA, ו -2,634 היו בקבוצות טיפול שלא הכילו AVANDIA. תוצאות הביניים פורסמו 3 עבור RECORD (Rosiglitazone הערכה לתוצאות לב וויסות הגליקמיה ב- סוכרת), מחקר מתמשך של 6 שנים על תוצאות לב וכלי דם, בקרב חולים עם סוכרת סוג 2 עם טיפול ממוצע משך של 3.75 שנים. RECORD כולל חולים שנכשלו במונותרפיה עם מטפורמין או סולפונילוריאה; אלו שנכשלו במטפורמין מקבלים אקראיות לקבל AVANDIA או תוסף סולפונילאוריאה, ואלה שנכשלו בסולפונילוריאה מקבלים אקראיות לקבל תוסף AVANDIA או תוסף מטפורמין. ב- RECORD, בסך הכל 2,220 חולים מקבלים תוסף AVANDIA, ו -2,227 חולים נמצאים באחד ממשטרי ההרחבה שאינם מכילים AVANDIA.
עבור שלושת הניסויים הללו, בוצעו ניתוחים באמצעות קומפוזיט של אירועים קרדיווסקולריים שליליים משמעותיים (אוטם שריר הלב, מוות קרדיווסקולרי או שבץ מוחי), המכונה להלן MACE. נקודת קצה זו שונה מנקודת הקצה הרחבה של המטה-אנליזה של אירועים איסכמיים שריר הלב, אשר יותר ממחציתם היו תעוקת לב. אוטם שריר הלב כלל אוטם שריר הלב הקטלני והלא קטלני בתוספת מוות פתאומי. כפי שמוצג באיור 2, התוצאות עבור 3 נקודות הקצה (MACE, MI ו- Total Mortality) לא היו שונות באופן מובהק סטטיסטית בין AVANDIA לבין משווים.
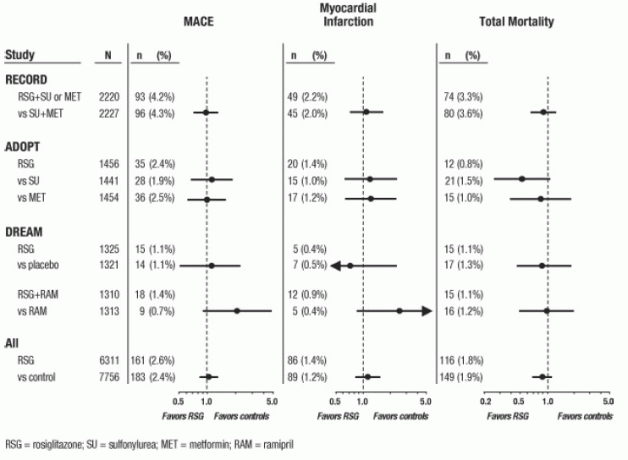
בניתוחים ראשוניים של ניסוי DREAM, שכיחות אירועים קרדיווסקולריים הייתה גבוהה יותר בקרב הנבדקים אשר קיבלה את AVANDIA בשילוב עם רמיפריל מאשר בקרב נבדקים שקיבלו רמיפריל בלבד, כפי שמודגם ב איור 2. ממצא זה לא אושר במחקרי ADOPT ו- RECORD (ניסויים מבוקרים פעילים בחולים עם סוכרת) בהם 30% ו -40% מהמטופלים בהתאמה, דיווחו על שימוש במעכבי ACE בתחילת הדרך.
במלואם, הנתונים הזמינים על הסיכון לאיסכמיה של שריר הלב אינם חד משמעיים. מסקנות מוחלטות ביחס לסיכון זה ממתינות לסיום מחקר תוצאות קרדיווסקולרי שתוכנן כראוי.
לא נערכו מחקרים קליניים אשר הוכיחו הוכחות חותכות להפחתת הסיכון המקרו-וסקולרי עם AVANDIA או כל תרופה אחרת נגד נוגדי סוכרת אוראלית.
אי ספיקת לב והפרעת איסכמיה של שריר הלב בזמן מתן טיפול משותף של AVANDIA עם אינסולין
במחקרים בהם התווסף AVANDIA לאינסולין, AVANDIA הגדיל את הסיכון לאי ספיקת לב וגרימת איסכמיה של שריר הלב. (ראה טבלה 2.)
אין צורך להעניק טיפול משותף של AVANDIA ואינסולין. [ראה אינדיקציות ושימוש ו אזהרות ואמצעי זהירות.]
בחמישה ניסויים מבוקרים, אקראיים, כפולים-עיוורים, שנכללו במטא-אנליזה [ראה אזהרות ואמצעי זהירות], חולים עם סוכרת מסוג 2 חולקו באופן אקראי למתן טיפול משותף של AVANDIA ואינסולין (N = 867) או אינסולין (N = 663). בחמשת הניסויים הללו נוספה AVANDIA לאינסולין. ניסויים אלה כללו חולים עם סוכרת ארוכת שנים (משך חציון של 12 שנים) ושכיחות גבוהה של קיימים מצבים רפואיים, כולל נוירופתיה היקפית, רטינופתיה, מחלת לב איסכמית, מחלות כלי דם ולב גודש כישלון. המספר הכולל של חולים עם אי ספיקת לב גודש היה 21 (2.4%) ו -7 (1.1%) בקרב AVANDIA בתוספת קבוצות אינסולין ואינסולין, בהתאמה. המספר הכולל של חולים עם איסכמיה שריר הלב התגלה היה 24 (2.8%) ו -9 (1.4%) באבנדיה בתוספת קבוצות אינסולין ואינסולין, בהתאמה (OR 2.1 [95% CI 0.9, 5.1]). למרות ששיעור האירועים לאי ספיקת לב ואיסכמיה של שריר הלב היה נמוך במחקר אוכלוסייה, בעקביות שיעור האירועים היה פי שניים ומעלה עם מתן טיפול משותף של AVANDIA ו- אינסולין. אירועים קרדיווסקולריים אלו נצפו במינון היומי של 4 מ"ג וגם 8 מ"ג של AVANDIA. (ראה טבלה 2.)
שולחן 2. התרחשות של אירועים קרדיווסקולריים ב -5 ניסויים מבוקרים של תוספת AVANDIA לטיפול אינסולין מבוסס
| אירוע * | AVANDIA + אינסולין (n = 867) n (%) |
אינסולין (n = 663) n (%) |
| אי ספיקת לב | 21 (2.4%) | 7 (1.1%) |
| איסכמיה שריר הלב | 24 (2.8%) | 9 (1.4%) |
| מורכב ממוות לב וכלי דם, אוטם שריר הלב או שבץ מוחי | 10 (1.2%) | 5 (0.8%) |
| שבץ | 5 (0.6%) | 4 (0.6%) |
| אוטם שריר הלב | 4 (0.5%) | 1 (0.2%) |
| מוות קרדיווסקולרי | 4 (0.5%) | 1 (0.2%) |
| כל מקרי המוות | 6 (0.7%) | 1 (0.2%) |
| * אירועים אינם בלעדיים; כלומר, חולה עם מוות קרדיווסקולרי עקב אוטם שריר הלב ייספר ב -4 קטגוריות אירוע (איסכמיה שריר הלב; מוות קרדיווסקולרי, אוטם שריר הלב או שבץ מוחי; אוטם שריר הלב; מוות קרדיווסקולרי). |
במחקר שישי, 24 שבועות, מבוקר, רנדומלי, כפול סמיות של AVANDIA וטיפול משותף באינסולין, נוספה אינסולין ל- AVANDAMET® (rosiglitazone maleate ו- metformin HCl) (n = 161) והשווה לאינסולין פלוס פלסבו (n = 158), לאחר ריצה חד עיוורת של 8 שבועות עם AVANDAMET. חולים עם בצקת הזקוקים לטיפול פרמקולוגי ואנשים הסובלים מאי ספיקת לב, הוחרגו בתחילת הדרך ובמהלך ההפעלה.
בקבוצה שקיבלה AVANDAMET פלוס אינסולין היה אירוע איסכמי שריר הלב אחד ומוות פתאומי. לא נצפתה איסכמיה שריר הלב בקבוצת האינסולין, ולא דווח על אי ספיקת לב גודש בשתי קבוצות הטיפול.
בצקת
יש להשתמש בזהירות ב- AVANDIA בחולים עם בצקת. במחקר קליני בקרב מתנדבים בריאים שקיבלו 8 מ"ג AVANDIA פעם ביום במשך 8 שבועות, נרשמה עלייה מובהקת סטטיסטית בנפח הפלזמה החציוני בהשוואה לפלסבו.
מכיוון שתיאולידינדיונים, כולל רוזיגליטאזון, יכולים לגרום לאגירת נוזלים, מה שעלול להחמיר או להוביל לאי ספיקת לב, יש להשתמש בזהירות אצל AVANDIA בחולים בסיכון לב כישלון. יש לעקוב אחר חולים אחר סימנים ותסמינים של אי ספיקת לב [ראה אזהרה קופסת, אזהרות ואמצעי זהירות ].
במחקרים קליניים מבוקרים של חולים עם סוכרת מסוג 2, דווח על בצקת קלה עד בינונית בקרב חולים שטופלו ב- AVANDIA, ועשויה להיות קשורה למינון. חולים עם בצקת מתמשכת היו בעלי סבירות גבוהה יותר של תופעות לוואי הקשורות לבצקת אם הם התחילו בטיפול משולב עם אינסולין ו- AVANDIA [ראה תגובות שליליות].
עלייה במשקל
עלייה במשקל הקשורה במינון נצפתה עם AVANDIA בלבד ובשילוב עם חומרים היפוגליקמיים אחרים (טבלה 3). מנגנון העלייה במשקל אינו ברור אך ככל הנראה כרוך בשילוב של החזקת נוזלים והצטברות שומן.
בניסיון שלאחר השיווק, היו דיווחים על עלייה מהירה במיוחד במשקל ועלייה מעבר לזו שנצפתה בדרך כלל במחקרים קליניים. יש להעריך מטופלים החווים עלייה כזו לגבי הצטברות נוזלים ואירועים הקשורים לנפח כמו בצקת יתר ואי ספיקת לב [ראה אזהרה קופסת].
שולחן 3. שינויים במשקל (ק"ג) מתחילת הדרך בנקודת הקצה במהלך ניסויים קליניים
| טיפול במונותרפיה | משך הזמן | קבוצת שליטה | אבנדיה 4 מ"ג חציון (25, 75 אחוזון) |
אבנדיה 8 מ"ג חציון (25, 75 אחוזון) |
|
| חציון (25, 75 אחוזון) | |||||
| 26 שבועות | תרופת דמה | -0.9 (-2.8, 0.9) n = 210 |
1.0 (-0.9, 3.6) n = 436 |
3.1 (1.1, 5.8) n = 439 |
|
| 52 שבועות | sulfonylurea | 2.0 (0, 4.0) n = 173 |
2.0 (-0.6, 4.0) n = 150 |
2.6 (0, 5.3) n = 157 |
|
| טיפול משולב | |||||
| Sulfonylurea | 24-26 שבועות | sulfonylurea | 0 (-1.0, 1.3) n = 1,155 |
2.2 (0.5, 4.0) n = 613 |
3.5 (1.4, 5.9) n = 841 |
| מטפורמין | 26 שבועות | מטפורמין | -1.4 (-3.2, 0.2) n = 175 |
0.8 (-1.0, 2.6) n = 100 |
2.1 (0, 4.3) n = 184 |
| אינסולין | 26 שבועות | אינסולין | 0.9 (-0.5, 2.7) n = 162 |
4.1 (1.4, 6.3) n = 164 |
5.4 (3.4, 7.3) n = 150 |
| סולפונילוריאה + מטפורמין | 26 שבועות | sulfonylurea + metformin | 0.2 (-1.2, 1.6) n = 272 |
2.5 (0.8, 4.6) n = 275 |
4.5 (2.4, 7.3) n = 276 |
במחקר השוואתי בן 4-6 שנים, המונותרפיה, ADOPT, בקרב חולים שאובחנו לאחרונה עם סוכרת סוג 2 שלא טופלו בעבר בתרופות נגד סוכרת [ראה סטודנט קליניs], שינוי המשקל החציוני (25th, 75th אחוזונים) מההתחלה לאחר 4 שנים היה 3.5 ק"ג (0.0, 8.1) עבור AVANDIA, 2.0 ק"ג (-1.0, 4.8) לגלובריד ו- -2.4 ק"ג (-5.4, 0.5) עבור מטפורמין.
במחקר שנערך במשך 24 שבועות בקרב ילדים בגילאי 10 עד 17 שטופלו ב- AVANDIA 4 עד 8 מ"ג מדי יום, עלייה משקל של חציון של 2.8 ק"ג (25th, 75th אחוזונים: 0.0, 5.8) דווח.
השפעות כבד
יש למדוד אנזימי כבד לפני תחילת הטיפול ב- AVANDIA בכל החולים ותקופתיות לאחר מכן לפי שיקול דעתו הקליני של איש המקצוע הרפואי. אין להתחיל טיפול באמצעות AVANDIA בחולים עם עלייה ברמת האנזים בכבד (ALT> 2.5X גבול עליון של תקין). חולים עם אנזימי כבד מוגבהים קלות (רמות ALT - 2.5X גבול עליון רגיל) בתחילת המחקר או במהלך הטיפול עם AVANDIA יש לבחון את הגורם לאנזים הכבד הגבהה. יש להתחיל בזהירות או להמשך טיפול עם AVANDIA בחולים עם העלאת אנזים כבד קלה. וכוללים מעקב קליני צמוד, כולל ניטור אנזימי כבד, כדי לקבוע אם עליות האנזים בכבד פוסקות או להחמיר. אם בכל עת רמות ALT עולות ל> 3X הגבול העליון של הנורמלי בקרב חולים המטופלים ב- AVANDIA, יש לבדוק שוב את רמות האנזים בכבד בהקדם האפשרי. אם נותרו רמות ALT> 3X מהגבול העליון של הרגיל, יש להפסיק את הטיפול ב- AVANDIA.
אם חולה כלשהו מפתח סימפטומים המצביעים על תפקוד של הכבד, אשר עשויים לכלול בחילה בלתי מוסברת, הקאות, כאבי בטן, עייפות, אנורקסיה ו / או שתן כהה, יש לבדוק אנזימי כבד. ההחלטה אם להמשיך את המטופל בטיפול באמצעות AVANDIA צריכה להיות מונחת על ידי שיקול דעת קליני ממתין להערכות מעבדה. אם נצפתה צהבת, יש להפסיק את הטיפול התרופתי. [ראה תגובות שליליות.]
בצקת מקולרית
דווח על בצקת מקולרית לאחר ניסיון השיווק בקרב חלק מהסובלים מסוכרת שנטלו AVANDIA או תיאזולידינדיון אחר. חלק מהמטופלים הציגו ראייה מטושטשת או ירידה בחדות הראייה, אולם נראה כי חלק מהמטופלים אובחנו בבדיקה עיניים שגרתית. מרבית החולים סבלו מבצקת היקפית בזמן שאובחנה בצקת מקולרית. חלק מהמטופלים חלו שיפור בבצקת המקולרית שלהם לאחר הפסקת התיאולידינדיון שלהם. חולים עם סוכרת צריכים לעבור בדיקות עיניים קבועות על ידי רופא עיניים, בהתאם לתקני הטיפול של איגוד הסוכרת האמריקני. בנוסף, כל חולי סוכרת המדווחים על כל סימפטום ויזואלי יש להפנות מיד לרופא עיניים, ללא קשר לתרופות הבסיסיות של המטופל או לממצאים גופניים אחרים. [ראה תגובות שליליות.]
שברים
במחקר השוואתי בן 4-6 שנים (ADOPT) על שליטה גליקמית עם מונותרפיה בקרב חולים שלא היו תרופתיים לאחרונה כאשר אובחנה כחולה סוכרת מסוג 2, נצפתה שכיחות מוגברת של שבר בעצמות בקרב נשים שנטלו אבנדיה. במהלך התקופה של 4-6 שנים, שכיחות שבר העצם אצל הנקבות הייתה 9.3% (60/645) עבור AVANDIA לעומת 3.5% (21/605) לגלובריד ו- 5.1% (30/590) עבור מטפורמין. שכיחות מוגברת זו נצפתה לאחר השנה הראשונה לטיפול ונמשכה במהלך המחקר. מרבית השברים אצל הנשים שקיבלו AVANDIA התרחשו בזרוע העליונה, ביד וכף הרגל. אתרי שבר אלה שונים מאלו הקשורים בדרך כלל לאוסטיאופורוזיס לאחר גיל המעבר (למשל, ירך או עמוד שדרה). לא נצפתה עלייה בשיעורי השברים בגברים שטופלו ב- AVANDIA. יש לקחת בחשבון את הסיכון לשבר בטיפול בחולים, בעיקר נשים חולות, המטופלות AVANDIA, ותשומת לב שניתנה להערכת ושמירה על בריאות העצם על פי הסטנדרטים הנוכחיים של אכפת.
השפעות המטולוגיות
ירידות בממוגלובין והמטוקריט הממוצע התרחשו באופן שקשור למינון בקרב מטופלים בוגרים שטופלו ב- AVANDIA [ראה תגובות שליליות]. השינויים שנצפו עשויים להיות קשורים לנפח הפלזמה המוגבר שנצפה במהלך הטיפול ב- AVANDIA.
סוכרת ובקרת גלוקוז בדם
חולים המקבלים AVANDIA בשילוב עם חומרים היפוגליקמיים אחרים עשויים להיות בסיכון להיפוגליקמיה, וייתכן שיהיה צורך להפחתת המינון של החומר המקביל.
יש לבצע מדידות של גלוקוז בדם בצום ו- HbA1c כדי לפקח על התגובה הטיפולית.
ביוץ
טיפול עם AVANDIA, כמו תיאזולידינדייונים אחרים, עלול לגרום לביוץ אצל חלק מהנשים המעוררות לפני גיל המעבר. כתוצאה מכך, חולים אלו עשויים להיות בסיכון מוגבר להריון בזמן נטילת AVANDIA [ראה שימוש באוכלוסיות ספציפיות]. לפיכך, יש להמליץ על אמצעי מניעה הולם בקרב נשים לפני גיל המעבר. השפעה אפשרית זו לא נחקרה ספציפית במחקרים קליניים; לפיכך, התדירות של התרחשות זו אינה ידועה.
למרות שחוסר איזון הורמונלי נצפה במחקרים פרה-קליניים [ראה טוקסיקולוגיה לא קלינית], לא ידוע מה המשמעות הקלינית של ממצא זה. אם מתרחשת תפקוד לקוי של המחזור החודשי, יש לבחון את היתרונות של המשך הטיפול ב- AVANDIA.
חלק עליון
תגובות שליליות
ניסיון קליני קליני
מבוגר
במחקרים קליניים, כ- 9,900 חולים בסוכרת מסוג 2 טופלו ב- AVANDIA.
ניסויים קצרי טווח של AVANDIA כמונותרפיה ובשילוב עם סוכנים היפוגליקמיים אחרים
השכיחות וסוגי תופעות הלוואי שדווחו במחקרים קליניים קצרי טווח של AVANDIA כמונותרפיה מוצגים בלוח 4.
טבלה 4. אירועי לוואי (5% ¥ בכל קבוצת טיפולים) שדווחו על ידי חולים במחקרים קליניים כפולים עיוורים עם AVANDIA כמונותרפיה.
| מונח מועדף | אבנדיה טיפול במונותרפיה N = 2,526 % |
תרופת דמה N = 601 % |
מטפורמין N = 225 % |
Sulfonylureasâ € N = 626 % |
| זיהום בדרכי הנשימה העליונות | 9.9 | 8.7 | 8.9 | 7.3 |
| פציעה | 7.6 | 4.3 | 7.6 | 6.1 |
| כאב ראש | 5.9 | 5.0 | 8.9 | 5.4 |
| כאב גב | 4.0 | 3.8 | 4.0 | 5.0 |
| היפר גליקמיה | 3.9 | 5.7 | 4.4 | 8.1 |
| עייפות | 3.6 | 5.0 | 4.0 | 1.9 |
| סינוסיטיס | 3.2 | 4.5 | 5.3 | 3.0 |
| שלשול | 2.3 | 3.3 | 15.6 | 3.0 |
| היפוגליקמיה | 0.6 | 0.2 | 1.3 | 5.9 |
|
* הניסויים לטווח הקצר נעו בין 8 שבועות לשנה. †כולל חולים המקבלים גליבוריד (N = 514), גליקלאיד (N = 91) או גליפיזיד (N = 21). |
בסך הכל, סוגי התופעות הלוואי ללא התחשבות בסיבתיות דווחו בעת השימוש ב- AVANDIA בשילוב עם sulfonylurea או metformin היו דומים לאלה במהלך הטיפול במונותרפיה עם אבנדיה.
דיווחו על אירועים של אנמיה ובצקת בתדירות גבוהה יותר במינונים גבוהים יותר, ולרוב היו קלים עד בינוניים בדרגת חומרה ולרוב לא נדרשו הפסקת הטיפול ב- AVANDIA.
במחקרים דו-עיוורים דווח על אנמיה אצל 1.9% מהמטופלים שקיבלו AVANDIA כמונותרפיה לעומת 0.7% על פלצבו, 0.6% על סולפונילוריאה ו- 2.2% על מטפורמין. הדיווחים על אנמיה היו גדולים יותר בקרב חולים שטופלו בשילוב של AVANDIA ומטפורמין (7.1%) ובשילוב של AVANDIA וסולפונילוריאה בתוספת מטפורמין (6.7%) בהשוואה למונותרפיה עם AVANDIA או בשילוב עם סולפונילוריאה. (2.3%). רמות נמוכות יותר של המוגלובין / המטוקריט לפני הטיפול בקרב חולים שנרשמו לניסויים הקליניים בשילוב מטפורמין עשויים לתרום לשיעור הדיווח הגבוה יותר של אנמיה במחקרים אלה [ראה תגובות שליליות].
במחקרים קליניים דווח על בצקת אצל 4.8% מהמטופלים שקיבלו AVANDIA כמונותרפיה לעומת 1.3% בפלצבו, 1.0% בסולפונילוריאה ו -2.2% במטפורמין. שיעור הדיווחים על בצקת היה גבוה יותר עבור AVANDIA 8 מ"ג בשילובים סולפונילוריאה (12.4%) בהשוואה לשילובים אחרים, למעט אינסולין. דווח על בצקת בקרב 14.7% מהמטופלים שקיבלו AVANDIA במחקרי שילוב האינסולין לעומת 5.4% על אינסולין בלבד. דיווחים על הופעה או החמרה חדשה של אי ספיקת לב התרחשו בשיעור של 1% לאינסולין בלבד, ו -2% (4 מ"ג) ו- 3% (8 מ"ג) לאינסולין בשילוב עם AVANDIA [ראה אזהרה קופסת ו אזהרות ואמצעי זהירות].
במחקרי טיפול משולב מבוקר עם sulfonylurea, דווח על תסמינים היפוגליקמיים קלים עד בינוניים, שנראים קשורים למינון. מעטים מהמטופלים נסוגו בגלל היפוגליקמיה (<1%) ומעט פרקים של היפוגליקמיה נחשבו לחמורים (<1%). היפוגליקמיה הייתה תופעת הלוואי המדווחת ביותר במחקרי שילוב האינסולין במינון קבוע, למרות שמעט חולים נסוגו בגלל היפוגליקמיה (4 מתוך 408 עבור AVANDIA פלוס אינסולין ואחד מתוך 203 לאינסולין לבד). שיעורי ההיפוגליקמיה, שאושרו על ידי ריכוז הגלוקוז בדם הנימי - 50 מ"ג / ד"ל, היו 6% לאינסולין בלבד ו -12% (4 מ"ג) ו -14% (8 מ"ג) לאינסולין בשילוב עם AVANDIA. [ראה אזהרות ואמצעי זהירות.]
ניסוי ארוך טווח של AVANDIA כמונותרפיה
מחקר של 4-6 שנים (ADOPT) השווה את השימוש ב- AVANDIA (n = 1,456), glyburide (n = 1,441), ובמטפורמין (n = 1,454) כ מונותרפיה בחולים שאובחנו לאחרונה עם סוכרת מסוג 2 שלא טופלו בעבר בתרופות נגד סוכרת תרופות. טבלה 5 מציגה תגובות לוואי ללא התחשבות בסיבתיות; השיעורים באים לידי ביטוי ל 100 חשיפה לשנת חולים (PY) כדי להסביר את ההבדלים בחשיפה לתרופות המחקר בקרב שלוש קבוצות הטיפול.
ב- ADOPT דווח על שברים אצל מספר גדול יותר של נשים שטופלו ב- AVANDIA (9.3%, 2.7 / 100 שנות חולה) בהשוואה לגליבוריד (3.5%, 1.3 / 100 שנות חולה) או מטפורמין (5.1%, 1.5 / 100 שנות מטופל).
דווח על מרבית השברים אצל הנשים שקיבלו רוזיגליטזון בזרוע העליונה, ביד וכף הרגל. [ראה אזהרות ואמצעי זהירות.] ההיארעות שנצפתה של שברים אצל חולים גברים הייתה דומה בקרב שלוש קבוצות הטיפול.
טבלה 5. תופעות לוואי בטיפול (â ¥ 5 אירועים / 100 שנות חולה [PY]) בכל קבוצת טיפולים שדווחה במחקר קליני בן 4-6 שנים של AVANDIA כמונותרפיה (ADOPT)
| אבנדיה N = 1,456 PY = 4,954 |
גליבורייד N = 1,441 PY = 4,244 |
מטפורמין N = 1,454 PY = 4,906 |
|
| נזופרינגיטיס | 6.3 | 6.9 | 6.6 |
| כאב גב | 5.1 | 4.9 | 5.3 |
| דלקת פרקים | 5.0 | 4.8 | 4.2 |
| יתר לחץ דם | 4.4 | 6.0 | 6.1 |
| זיהום בדרכי הנשימה העליונות | 4.3 | 5.0 | 4.7 |
| היפוגליקמיה | 2.9 | 13.0 | 3.4 |
| שלשול | 2.5 | 3.2 | 6.8 |
ילדים
אבנדיה הוערכה כבטוחה במחקר בודד, מבוקר פעיל, בקרב חולי ילדים הסובלים מסוכרת מסוג 2, בהם 99 טופלו באבנדיה ו -101 טופלו במטפורמין. התופעות הלוואי השכיחות ביותר (> 10%) ללא התחשבות בסיבתיות לאבנדיה או למפורמין היו כאב ראש (17% לעומת 14%), בחילה (4% לעומת 11%), נזופרינגיטיס (3% לעומת 12%) ושלשול (1% לעומת 13%). במחקר זה דווח על מקרה אחד של קטואצידוזיס סוכרת בקבוצת המטפורמין. בנוסף, היו 3 חולים בקבוצת הרוזיגליטזון שסבלו מ- FPG של â300 מ"ג / ד"ל, 2+ קטונוריה, ופער אניון מוגבר.
חריגות מעבדה
המטולוגית
ירידות בממוגלובין והמטוקריט הממוצע התרחשו באופן שקשור למינון בקרב מטופלים בוגרים שטופלו עם אבנדיה (ירידה ממוצעת במחקרים פרטניים עד 1.0 גרם / מ"ל d המוגלובין וכ -3.3% המטוקריט). השינויים התרחשו בעיקר בשלושת החודשים הראשונים שלאחר התחלת הטיפול באבנדיה או בעקבות עליית מינון באבנדיה. משך הזמן ועוצמת הירידות היו דומים בחולים שטופלו בשילוב של אבנדיה וסוכנים היפוגליקמיים אחרים או מונותרפיה עם אבנדיה. רמות טרום הטיפול של המוגלובין והמטוקריט היו נמוכות יותר בקרב מטופלים במחקרי שילוב מטפורמין וייתכן שתרמו לשיעור הדיווח הגבוה יותר של אנמיה. במחקר יחיד שנערך בקרב ילדים, דווח על ירידות בהמוגלובין והמטוקריט (ממוצע ירידות של 0.29 גרם לד"ל ו -0.95% בהתאמה). דווחו ירידות קטנות בהמוגלובין והמטוקריט בקרב חולים ילדים שטופלו באבנדיה. ספירת תאי הדם הלבנים פחתה גם היא מעט בקרב חולים בוגרים שטופלו באבנדיה. ירידות בפרמטרים המטולוגיים עשויות להיות קשורות לעליה בנפח הפלזמה שנצפתה במהלך הטיפול באבנדיה.
ליפידים
שינויים בשומנים בנסיוב נצפו לאחר טיפול באבנדיה אצל מבוגרים [ראה פרמקולוגיה קלינית ]. דיווחים על שינויים קטנים בפרמטרים של ליפידים בסרום בילדים שטופלו באבנדיה במשך 24 שבועות.
רמות טרנסאמינאז סרום
במחקרים קליניים שאושרו מראש בקרב 4,598 חולים שטופלו באבנדיה (3,600 שנות חשיפה לחולה) וב 4- עד 4 שנים לטווח הארוך במחקר בן 6 שנים בקרב 1,456 חולים שטופלו באבנדיה (4,954 חשיפה לשנת חולים), לא היו שום עדות להשראת תרופות רעילות כבד.
במחקרים מבוקרים שאושרו מראש, 0.2% מהמטופלים שטופלו באבנדיה היו בעלייה ב- ALT> 3X הגבול העליון של הנורמלי לעומת 0.2% בפלסבו ו 0.5% בהשוואה לפעילים. עליות ה- ALT בחולים שטופלו באבנדיה היו הפיכות. היפרבילירובינמיה נמצאה בקרב 0.3% מהחולים שטופלו באבנדיה בהשוואה ל -0.9% שטופלו בפלצבו ו -1% בחולים שטופלו בהשוואה פעילה. בניסויים קליניים שקיבלו אישור מראש, לא היו מקרים של תגובות תרופתיות אידיוסינקרטיות שהובילו לאי ספיקת כבד. [ראה אזהרות ואמצעי זהירות]
בניסוי ה- ADOPT שנמשך 4-6 שנים, חולים שטופלו באבנדיה (חשיפה של 4,954 שנות חולה), גליבוריד (4,244 חשיפה לשנתיות), או למטפורמין (4,906 חשיפה לשנת חולה), כמונתרפיה, היה שיעור זהה של עליית ALT ל> 3X גבול עליון של תקין (0.3 לכל 100 שנות חולה) חשיפה).
חוויה לאחר שיווק
בנוסף לתגובות לוואי שדווחו ממחקרים קליניים, האירועים המתוארים להלן זוהו במהלך השימוש שלאחר האישור באבנדיה. מכיוון שמדברים על אירועים אלה בהתנדבות מאוכלוסייה בגודל לא ידוע, לא ניתן להעריך באופן אמין את תדירותם או ליצור קשר סיבתי תמיד לחשיפה לתרופות.
בקרב מטופלים המקבלים טיפול בתיאולידידיוניון, עלולים להיות תופעות לוואי חמורות עם או בלי תוצאה קטלנית דיווחו על התרחבות נפח (למשל, אי ספיקת לב, בצקת ריאות, ונגיף pleural). [ראה אזהרת קופסא ו אזהרות ואמצעי זהירות].
ישנם דיווחים לאחר שיווק עם Avandia של דלקת כבד, העלאות אנזים בכבד עד פי 3 או יותר הגבול העליון של כישלון תקין, וכבד עם תוצאה קטלנית וללא תוצאה, למרות שלא הייתה הסיבתיות הוקמה.
דיווחו לעתים נדירות על פריחה, דלקת פרוטוס, אורטיקריה, אנגיואדמה, תגובה אנפילקטית ותסמונת סטיבנס-ג'ונסון.
התקבלו דיווחים על הופעת בצקת מקולרית סוכרתית עם ירידת חדות הראיה החדשה או החמרה בה [ אזהרות ואמצעי זהירות].
חלק עליון
אינטראקציות סמים
מעכבי ומאיץ CYP2C8
מעכב של CYP2C8 (למשל, גמפריברוזיל) עשוי להעלות את ה- AUC של רוזיגליטאזון ומניע של CYP2C8 (למשל, ריפאמפין) עשוי להפחית את ה- AUC של רוזיגליטזון. לפיכך, אם מתחילים או נעצרים מעכב או גורם ממריץ של CYP2C8 במהלך הטיפול ברוזיגליטאזון, יתכן שיהיה צורך בשינויים בטיפול בסוכרת על סמך תגובה קלינית. [ראה פרמקולוגיה קלינית.]
חלק עליון
שימוש באוכלוסיות ספציפיות
הריון
הריון קטגוריה ג.
לכל ההריונות יש סיכון רקע למומים מולדים, אובדן או תוצאה שלילית אחרת ללא קשר לחשיפה לתרופות. סיכון רקע זה מוגבר בהריונות המסובכים מהיפרגליקמיה ועשוי להיות מופחת עם בקרה מטבולית טובה. חיוני לחולים עם סוכרת או היסטוריה של סוכרת הריון לשמור על שליטה מטבולית טובה לפני ההתעברות ולאורך כל ההיריון. מעקב קפדני אחר בקרת הגלוקוז חיוני בחולים כאלה. מרבית המומחים ממליצים להשתמש במונותרפיה של אינסולין במהלך ההיריון בכדי לשמור על רמות הגלוקוז בדם ככל האפשר.
נתונים אנושיים: דווח כי רוזיגליטזון חוצה את השלייה האנושית וניתנת לניתוח ברקמות העובר. המשמעות הקלינית של ממצאים אלה אינה ידועה. אין מחקרים מתאימים ומבוקרים היטב בקרב נשים הרות. אין להשתמש ב- AVANDIA במהלך ההיריון.
לימודי בעלי חיים: לא הייתה השפעה על השתלה או על העובר בטיפול ברוזיגליטאזון במהלך ההיריון המוקדם אצל חולדות, אך הטיפול במהלך ההיריון באמצע המאוחר היה קשור למוות בעובר ופיגור גדילה אצל חולדות וארנבונים כאחד. טרטוגניות לא נצפתה במינונים של עד 3 מ"ג / ק"ג אצל חולדות ו 100 מ"ג / ק"ג אצל ארנבים (בערך 20 ו־ 75 פעמים AUC אנושי במינון היומי המומלץ המומלץ אנושי, בהתאמה). רוזיגליטזון גרם לפתולוגיה שליה אצל חולדות (3 מ"ג / ק"ג ליום). הטיפול בחולדות במהלך ההיריון דרך ההנקה הפחית את גודל המלטה, את הכדאיות בילודים ואת הצמיחה לאחר הלידה, כאשר פיגור הצמיחה הפיך לאחר גיל ההתבגרות. להשפעות על השלייה, העובר / העובר והצאצא, המינון ללא השפעה היה 0.2 מ"ג / ק"ג / יום אצל חולדות ו -15 מ"ג / ק"ג / יום אצל ארנבים. רמות ללא השפעה אלה הן בערך פי 4 מה AUC האנושי במינון היומי המומלץ המומלץ לאדם. רוזיגליטזון צמצם את מספר השתלות הרחם וצאצאים חיים כאשר חולדות נקבות צעירות טופלו בגיל 40 מ"ג / ק"ג ליום מגיל 27 יום ועד לבגרות מינית (בערך פי 68 מה AUC האנושי במקסימום המומלץ ליום מנה). רמת ללא השפעה הייתה 2 מ"ג / ק"ג ליום (בערך פי 4 AUC אנושי במינון היומי המומלץ המקסימלי). לא הייתה כל השפעה על ההישרדות או הצמיחה לפני הלידה או לאחר הלידה.
עבודה ומשלוח
לא ידוע מה ההשפעה של רוזיגליטזון על הלידה והלידה בבני אדם.
אמהות סיעודיות
חומר שקשור לתרופות התגלה בחלב מחולדות מניקות. לא ידוע אם AVANDIA מופרש בחלב אנושי. מכיוון שתרופות רבות מופרשות בחלב אנושי, אין להעניק AVANDIA לאישה מניקה.
שימוש בילדים
לאחר הפעלת פלצבו כולל ייעוץ דיאטטי, ילדים עם סוכרת סוג 2, בגילאי 10 עד 17 שנים עם מדד מסת מסת גוף ממוצא (BMI) הממוצע של 33 ק"ג / מ ', חולקו באופן אקראי לטיפול עם 2 מ"ג פעמיים ביום של AVANDIA (n = 99) או 500 מ"ג פעמיים ביום של מטפורמין (n = 101) במרפאה קלינית כפולה-עיוורת של 24 שבועות ניסוי. כצפוי, ה- FPG פחת בקרב חולים שטרם הגיעו לתרופות לסוכרת (n = 104) ועלו בקרב חולים שנסוגו מתרופות קודמות (בדרך כלל מטפורמין) (n = 90) במהלך תקופת ההרצה. לאחר לפחות 8 שבועות של טיפול, 49% מהמטופלים שטופלו ב- AVANDIA ו- 55% מהמטופלים שטופלו במטפורמין הכילו את המינון שלהם אם FPG היה> 126 מ"ג / ד"ל. באוכלוסייה הכוללת בכוונה לטיפול, בשבוע 24, השינוי הממוצע ממוצא הבסיס ב- HbA1c היה -0.14% עם AVANDIA ו- -0.49% עם מטפורמין. לא נמצא כמות מספקת של חולים במחקר זה כדי לקבוע סטטיסטית אם אלה
השפעות הטיפול הממוצע נצפו היו דומות או שונות. השפעות הטיפול היו שונות בקרב חולים שלא היו בעבר לטיפול בתרופות נוגדות סוכרת ובקרב חולים שטופלו בעבר בטיפול נוגדי סוכרת (טבלה 6).
טבלה 6. שבוע 24 ה- FPG ו- HbA1c משתנה מההתחלה לאחר התצפית האחרונה שהועברה בילדים עם ילדים עם קו ההתחלה HbA1c> 6.5%
| חולים נאווי | חולים שטופלו בעבר | |||
|
מטפורמין N = 40 |
רוזיגליטזון N = 45 |
מטפורמין N = 43 |
רוזיגליטזון N = 32 |
|
| FPG (mg / dL) | ||||
| קו בסיס (ממוצע) | 170 | 165 | 221 | 205 |
| שינוי מקו הבסיס (ממוצע) | -21 | -11 | -33 | -5 |
| הפרש טיפול מותאם * (rosiglitazone-metformin) - 95% CI) | 8 (-15, 30) |
21 (-9, 51) |
||
| % מהמטופלים עם 30 מ"ג / ליטר dL יורדים מתחילת הבסיס | 43% | 27% | 44% | 28% |
| HbA1c (%) | ||||
| קו בסיס (ממוצע) | 8.3 | 8.2 | 8.8 | 8.5 |
| שינוי מקו הבסיס (ממוצע) | -0.7 | -0.5 | -0.4 | 0.1 |
| הפרש טיפול מותאם * (rosiglitazone-metformin) - 95% CI) | 0.2 (-0.6, 0.9) |
0.5 (-0.2, 1.3) |
||
| % מהמטופלים עם 0.7% - ירידה מתחילת הבסיס | 63% | 52% | 54% | 31% |
|
* שינוי מאמצעי הבסיס הם הכי פחות ריבועים פירושו התאמה עבור HbA1c, מין ואזור בסיסי. †ערכים חיוביים להבדל מעדיפים מטפורמין. |
ההבדלים בטיפול היו תלויים במערכת הבסיסי במשקל או במשקל כך שההשפעות של AVANDIA ומטפורמין נראו דומות יותר בקרב חולים כבדים יותר. העלייה החציונית במשקל הייתה 2.8 ק"ג עם רוזיגליטאזון ו -0.2 ק"ג עם מטפורמין [ראה אזהרות ואמצעי זהירות]. חמישים וארבעה אחוזים מהמטופלים שטופלו ברוזיגליטזון ו- 32% מהמטופלים שטופלו במטפורמין צברו â ¥ 2 ק"ג, ו -33% מהמטופלים שטופלו ברוזיגליטזון ו -7% מהמטופלים שטופלו במטפורמין גברו 5 ק"ג על לימוד.
תופעות לוואי שנצפו במחקר זה מתוארות בתגובות לוואי).
איור 3. ממוצע HbA1c לאורך זמן במחקר שנערך במשך 24 שבועות על AVANDIA ומטפורמין בקרב חולים ילדים - תת-קבוצת תרופות נאווה

שימוש גריאטרי
תוצאות הניתוח הפרמקוקינטטי באוכלוסייה הראו כי הגיל אינו משפיע באופן משמעותי על הפרמקוקינטיקה של רוזיגליטאזון [ראה פרמקולוגיה קלינית]. לכן, אין צורך בהתאמות מינון לקשישים. במחקרים קליניים מבוקרים לא נצפו הבדלים כלליים בבטיחות וביעילות בין חולים מבוגרים (65+ שנים) לחולים צעירים יותר (<65 שנים).
חלק עליון
מינון יתר
נתונים מוגבלים זמינים לגבי מינון יתר בבני אדם. במחקרים קליניים במתנדבים, AVANDIA ניתנה במינונים יחידניים של הפה עד 20 מ"ג וסבלו היטב. במקרה של מנת יתר, יש להתחיל בטיפול תומך מתאים כפי שמוכתב על ידי מצבו הקליני של המטופל.
חלק עליון
תיאור
AVANDIA (rosiglitazone maleate) הוא חומר אנטי-סוכרת אוראלי, הפועל בעיקר על ידי הגברת הרגישות לאינסולין. AVANDIA משפר את השליטה הגליקמית תוך הפחתת רמות האינסולין במחזור.
רוליגליטזון maleate אינו קשור כימית או פונקציונלית לסולפונילוריאות, לביגואנידים או למעכבי האלפא-גלוקוזידאז.
מבחינה כימית, רוזיגליטאזון מליאט הוא (±) -5 - [[4- [2- (מתיל-2-פירידינילמינו) אתוקסי] פניל] מתיל] -2,4-טיאזולידינדיון, (Z) -2-בוטנדיאט (1: 1) במשקל מולקולרי של 473.52 (בסיס 357.44 חופשי). למולקולה יש מרכז כיראלי יחיד והיא נוכחת כרמת גזע. בשל המרה מהירה, ניתן להבחין בין האנציומומרים לתפקוד. הפורמולה המבנית של רוזיגליטאזון maleate היא:
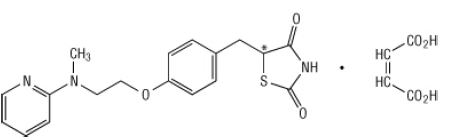
הנוסחה המולקולרית היא C18H19N3O3S-C4H4O4. Maleate Rosiglitazone הוא מוצק לבן עד לבן-לבן עם טווח נקודת התכה בין 122 עד 123 מעלות צלזיוס. ערכי ה- pKa של maleate rosiglitazone הם 6.8 ו- 6.1. זה מסיס בקלות באתנול ובא תמיסה מימית חוצץ עם pH של 2.3; המסיסות יורדת עם עליית ה- pH בפיזיולוגי טווח.
כל טבלית TILTAB מצופה סרט מחומש מכילה רוזיגליטאזון maleate המקבילה לרוזיגליטזון, 2 מ"ג, 4 מ"ג או 8 מ"ג, למתן דרך הפה. רכיבים לא פעילים הם: Hypromellose 2910, monohydrate לקטוז, מגנזיום סטרט, תאית מיקרו-גבישית, פוליאתילן גליקול 3000, גליקולאט עמילן נתרן, דו תחמוצת טיטניום, טריאצטין, ואחת או יותר מהאפשרויות הבאות: תחמוצות ברזל אדום וצהוב סינטטי ו טלק.
חלק עליון
פרמקולוגיה קלינית
מנגנון פעולה
רוזיגליטזון, חבר בכיתה של תרופות נגד תרופות נגד סוכרת, משפר את השליטה הגליקמית על ידי שיפור הרגישות לאינסולין. רוזיגליטאזון הוא אגוניסט מאוד סלקטיבי ועוצמתי עבור הקולטן-גמא המופעל על ידי פרוקסיסום (PPARγ). אצל בני אדם, קולטני PPAR נמצאים ברקמות יעד מרכזיות לפעולה של אינסולין כמו רקמת שומן, שריר שלד וכבד. הפעלת קולטני PPARγ גרעיניים מווסתת את התעתיק של גנים המגיבים לאינסולין המעורבים בבקרה על ייצור, תחבורה וניצול גלוקוז. בנוסף, גנים בעלי תגובה PPARγ משתתפים גם בוויסות חילוף החומרים של חומצות השומן.
עמידות לאינסולין היא תכונה נפוצה המאפיינת את הפתוגנזה של סוכרת מסוג 2. הפעילות האנטי-סוכרתית של רוזיגליטאזון הודגמה במודלים של בעלי חיים של סוכרת מסוג 2 בשנת אשר היפרגליקמיה ו / או פגיעה בסובלנות לגלוקוז הם תוצאה של עמידות לאינסולין ביעד רקמות. רוזיגליטאזון מפחית את ריכוזי הגלוקוז בדם ומפחית את היפר-אינסולינמיה בעכבר הסובלים מהשמנת יתר, סובלים מעכבי סוכרת db / db ובעכבר צוקר השומני / fa.
במודלים של בעלי חיים, הוכח כי הפעילות האנטי-סוכרתית של רוזיגליטאזון מתווכת על ידי רגישות מוגברת לפעילות האינסולין ברקמות הכבד, השריר ושריר השומן. מחקרים פרמקולוגיים במודלים של בעלי חיים מצביעים על כך שרוזיגליטזון מעכב גלוקונוגנזה בכבד. הביטוי של טרנספורטר הגלוטוז המווסת באמצעות אינסולין GLUT-4 הוגבר ברקמת השומן. רוזיגליטזון לא גרם להיפוגליקמיה במודלים של בעלי חיים לסוכרת מסוג 2 ו / או לקוי בסובלנות לגלוקוז.
פרמקודינמיקה
חולים עם הפרעות בשומנים לא הוחרגו מניסויים קליניים של AVANDIA.
בכל הניסויים המבוקרים במשך 26 שבועות, בכל טווח המינונים המומלץ, AVANDIA כמונותרפיה היה קשור לעלייה ברמת הכולסטרול הכולל, LDL ו- HDL וירידה בחומצות השומן החופשיות. שינויים אלה היו שונים באופן מובהק מסטטיסטיקה מביקורת פלצבו או גליבוריד (טבלה 7).
עליות ב- LDL התרחשו בעיקר במהלך חודש עד חודשיים הראשונים לטיפול ב- AVANDIA ורמות LDL נותרו גבוהות מעל קו הבסיס לאורך כל הניסויים. לעומת זאת, HDL המשיך לעלות עם הזמן. כתוצאה מכך יחס ה- LDL / HDL הגיע לשיא לאחר חודשיים של טיפול ואז נראה היה שהוא יורד עם הזמן. בגלל האופי הזמני של שינויי ליפידים, המחקר שבשליטת הגלובריד בן 52 השבועות רלוונטי ביותר להערכת השפעות ארוכות טווח על השומנים. בתחילת המחקר, שבוע 26 ושבוע 52, הממוצע LDL / HDL ביחס הממוצע היה 3.1, 3.2 ו- 3.0 בהתאמה, עבור AVANDIA 4 מ"ג פעמיים ביום. הערכים המתאימים לגליבוריד היו 3.2, 3.1 ו- 2.9. ההבדלים בשינוי מקו הבסיס בין AVANDIA לגלוריד בשבוע 52 היו מובהקים סטטיסטית.
התבנית של שינויים ב- LDL ו- HDL בעקבות טיפול ב- AVANDIA בשילוב עם חומרים היפוגליקמיים אחרים היו בדרך כלל דומים לאלה שנראו עם AVANDIA במונותרפיה.
השינויים בטריגליצרידים במהלך הטיפול ב- AVANDIA היו משתנים ובאופן כללי לא היו שונים מבחינה סטטיסטית מביקורת פלצבו או של גליבוריד.
טבלה 7. סיכום שינויים ממוצעים של ליפידים במחקרים על טיפול מונופולי בשילוב של פלסבו וב -52 שבועות.
| מחקרים מבוקרים פלסבו שבוע 26 | שבוע 26 ושבוע 52 במחקר נשלט על ידי גליברייד | ||||||
| תרופת דמה | אבנדיה | טיטרציה של גליבורייד | AVANDIA 8 מ"ג | ||||
| 4 מ"ג מדי יום * | 8 מ"ג מדי יום * | Wk 26 | Wk 52 | Wk 26 | Wk 52 | ||
| חומצות שומן בחינם | |||||||
| נ | 207 | 428 | 436 | 181 | 168 | 166 | 145 |
| קו בסיס (ממוצע)% | 18.1 | 17.5 | 17.9 | 26.4 | 26.4 | 26.9 | 26.6 |
| שינוי מקו הבסיס (ממוצע) | +0.2% | -7.8% | -14.7% | -2.4% | -4.7% | -20.8% | -21.5% |
| LDL | |||||||
| נ | 190 | 400 | 374 | 175 | 160 | 161 | 133 |
| קו בסיס (ממוצע)% | 123.7 | 126.8 | 125.3 | 142.7 | 141.9 | 142.1 | 142.1 |
| שינוי מקו הבסיס (ממוצע) | +4.8% | +14.1% | +18.6% | -0.9% | -0.5% | +11.9% | +12.1% |
| HDL | |||||||
| נ | 208 | 429 | 436 | 184 | 170 | 170 | 145 |
| קו בסיס (ממוצע)% | 44.1 | 44.4 | 43.0 | 47.2 | 47.7 | 48.4 | 48.3 |
| שינוי מקו הבסיס (ממוצע) | +8.0% | +11.4% | +14.2% | +4.3% | +8.7% | +14.0% | +18.5% |
| * פעם אחת ביום ופעמיים ביום שולבו קבוצות מינון. |
פרמקוקינטיקה
ריכוז הפלזמה המרבי (Cmax) והאזור שמתחת לעיקול (AUC) של רוזיגליטאזון עולה באופן פרופורציונלי במינון על פני טווח המינון הטיפולי (טבלה 8). זמן מחצית החיים של חיסול הוא 3 עד 4 שעות ואינו תלוי במינון.
טבלה 8. פרמטרים פרמקוקינטטיים ממוצעים (SD) לרוזיגליטזון לאחר מינון אוראלי יחיד (N = 32)
| פרמטר | צום של 1 מ"ג | צום של 2 מ"ג | צום של 8 מ"ג | 8 מ"ג פד |
| AUC0 אינפ [ng-hr / mL] |
358 (112) |
733 (184) |
2,971 (730) |
2,890 (795) |
| Cmax [ng / mL] |
76 (13) |
156 (42) |
598 (117) |
432 (92) |
| חצי חיים [שעות] |
3.16 (0.72) |
3.15 (0.39) |
3.37 (0.63) |
3.59 (0.70) |
| CL / F * [L / hr] |
3.03 (0.87) |
2.89 (0.71) |
2.85 (0.69) |
2.97 (0.81) |
| * CL / F = אישור אוראלי. |
קליטה
הזמינות הביולוגית המוחלטת של רוזיגליטאזון היא 99%. ריכוזי שיא בפלזמה נצפים כשעה לאחר המינון. מתן רוזיגליטאזון עם מזון לא הביא לשינוי בחשיפה הכללית (AUC), אך חלה ירידה של כ- 28% ב- Cmax ועיכוב ב- Tmax (1.75 שעות). לא סביר כי שינויים אלה יהיו משמעותיים קלינית; לכן AVANDIA יכול להינתן עם או בלי מזון.
הפצה
נפח ההפצה האוראלי (VS / F) של רוזיגליטאזון הממוצע (% CV) הוא כ- 17.6 (30%) ליטר, על סמך ניתוח פרמקוקינטי באוכלוסייה. רוזיגליטזון כרוך בכ- 99.8% לחלבוני פלזמה, בעיקר אלבומין.
חילוף חומרים
רוזיגליטזון מטבוליזם נרחב ללא תרופה ללא שינוי מופרשת בשתן. דרכי חילוף החומרים העיקריות היו N-demethylation והידרוקסילציה, ואחריו התחברות עם סולפט וחומצה גלוקורונית. כל המטבוליטים המסתובבים הם פחות משמעותיים מההורה, ולכן הם לא צפויים לתרום לפעילות הרגישות לאינסולין של רוזיגליטאזון.
נתונים חוץ גופיים מדגימים כי רוזיגליטזון מטבוליזם בעיקר על ידי האיזואנזים 2C8 Cytochrome P450 (CYP), כאשר CYP2C9 תורם כמסלול מינורי.
הפרשה
לאחר מתן דרך הפה או הווריד של maleate [14C] rosiglitazone, כ -64% וכ -23% מהמינון בוטלו בשתן ובצואה, בהתאמה. זמן מחצית החיים של הפלזמה של חומר הקשור ל- [14C] נע בין 103 ל- 158 שעות.
אוכלוסיית פרמקוקינטיקה בקרב חולים עם סוכרת סוג 2
ניתוחים פרמקוקינטטיים לאוכלוסייה משלושה מחקרים קליניים גדולים הכוללים 642 גברים ו -405 נשים עם סוכרת סוג 2 (גיל 35) עד 80 שנה) הראו שהפרמקוקינטיקה של רוזיגליטאזון לא מושפעת מגיל, גזע, עישון או אלכוהול צריכה. כמו כן, הוכח כי שחרור הפה (CL / F) וגם נפח ההפצה של מצב יציב דרך הפה (Vss / F) עלה עם עלייה במשקל הגוף. על טווח המשקל שנצפה בניתוחים אלה (50 עד 150 ק"ג), טווח הערכים המשוערים של CL / F ו- Vss / F השתנה בין פי 1.7 ו <2.3 פי, בהתאמה.
בנוסף, רוזיגליטזון CL / F הוכח כי הושפע משני ומשקל הן מגדר, והינו נמוך יותר (כ -15%) בקרב נשים.
אוכלוסיות מיוחדות
גריאטרי
תוצאות הניתוח הפרמקוקינטטי של האוכלוסייה (n = 716 <65 שנים; n = 331 - 65 שנים) הראה כי הגיל אינו משפיע באופן משמעותי על הפרמקוקינטיקה של רוזיגליטזון.
מגדר
תוצאות ניתוח הפרמקוקינטיקה של האוכלוסייה הראו כי ההתמחות האוראלית הממוצעת של רוזיגליטאזון ב נשים חולות (n = 405) היו נמוכות בכ- 6% בהשוואה לחולים גברים באותו משקל גוף (n = 642).
כמונותרפיה ובשילוב עם מטפורמין, AVANDIA שיפרה את השליטה הגליקמית אצל גברים ונשים כאחד. במחקרי שילוב מטפורמין הוכח יעילות ללא הבדלים מגדריים בתגובה הגליקמית.
במחקרים המונותרפיים נצפתה תגובה טיפולית גדולה יותר בקרב נשים; עם זאת, בקרב חולים שמנים יותר, ההבדלים בין המינים היו פחות בולטים. עבור מדד מסת גוף מסוים (BMI) נתון, נוטות להיות בעלות מסת שומן גדולה יותר מזכרים. מכיוון שהיעד המולקולרי PPARγ מתבטא ברקמות שומן, מאפיין מבדיל זה עשוי להסביר, לפחות בחלקו, את התגובה הגדולה יותר לאבנדיה אצל נקבות. מכיוון שיש להתאים את הטיפול באופן אינדיבידואלי, אין צורך בהתאמת מינון על בסיס מין בלבד.
ספיקת כבד
השחרור הבלתי-מוגבר דרך הפה של rosiglitazone היה נמוך משמעותית בקרב חולים עם מחלת כבד בינונית עד קשה (Child-Pugh Class B / C) בהשוואה לנבדקים בריאים. כתוצאה מכך, הגדלת Cmax וה- AUC0- infund לא מוגבלים פי שלושה ו -3, בהתאמה. מחצית החיים של חיסול הרוזיגליטזון ארכה כשעתיים בקרב חולים במחלת כבד, בהשוואה לנבדקים בריאים.
אין להתחיל טיפול באמצעות AVANDIA אם המטופל מגלה הוכחות קליניות לפעילות מחלת כבד או עלייה ברמת הטרנסמינז סרום (ALT> 2.5X גבול עליון מהנורמה) בתחילת הדרך [ראה אזהרות ואמצעי זהירות].
ילדים
הפרמטרים הפרמקוקינטיים של רוזיגליטאזון בקרב חולים ילדים נקבעו על ידי ניתוח פרמקוקינטטי של אוכלוסייה עם נתונים דלילים מ -96 ילדים בניסוי קליני יחיד בילדים הכוללים 33 גברים ו -63 נשים עם גילאים הנעים בין 10 ל -17 שנים (משקולות הנעים בין 35 ל- 178.3 ק"ג). ממוצע האוכלוסייה CL / F ו- V / F של rosiglitazone היה 3.15 ליטר לשעה ו -13.5 ליטר, בהתאמה. הערכות אלה של CL / F ו- V / F היו בקנה אחד עם אומדני הפרמטרים האופייניים מניתוח אוכלוסיה מבוגרים קודם.
ליקוי כלייתי
אין הבדלים רלוונטיים קלינית בפרמקוקינטיקה של רוזיגליטאזון בקרב חולים עם קל לפגיעה כלייתית קשה או בחולים תלויי המודיאליזה בהשוואה לנבדקים עם כליה תקינה פונקציה. לכן אין צורך בהתאמת מינון בחולים כאלה המקבלים AVANDIA. מכיוון שמטפורמין אינו מתייחס לשימוש בחולים עם לקות כליות, מתן מתן-תוספת של מטפורמין עם AVANDIA לחולים אלה.
גזע
תוצאות ניתוח פרמקוקינטטי באוכלוסייה, כולל נבדקים ממוצא אתני, קווקזי, שחור ומוצא אתני אחרים, מראים כי לגזע אין כל השפעה על הפרמקוקינטיקה של רוזיגליטאזון.
אינטראקציות בין תרופות
תרופות המעכבות, גורמות או מטבוליזם על ידי ציטוכרום P450
מחקרי חילוף חומרים חוץ-גופיים במבחנה מראים כי רוזיגליטזון אינו מעכב אף אחד מהאנזימים העיקריים P450 בריכוזים קליניים. נתונים חוץ גופיים מדגימים כי רוזיגליטזון מטבולית בעיקר על ידי CYP2C8, ובמידה פחותה, 2C9. ל- AVANDIA (4 מ"ג פעמיים ביום) לא הייתה השפעה רלוונטית קלינית על הפרמקוקינטיקה של אמצעי מניעה לניפדיפין ופה (אתניל אסטרדיול ונורינדינדרון), שמטבוליזם בעיקרם על ידי CYP3A4.
ג'מפיברוזיל
מתן מקביל של Gemfibrozil (600 מ"ג פעמיים ביום), מעכב CYP2C8 ורוזיגליטאזון (4 מ"ג פעם אחת מדי יום) במשך 7 ימים עלתה AUC ברוזיגליטאזון ב- 127%, בהשוואה למתן rosiglitazone (4 מ"ג פעם ביום) לבד. בהתחשב בפוטנציאל לתופעות לוואי הקשורות במינון עם רוזיגליטאזון, יתכן שתידרש ירידה במינון הרוזיגליטזון כאשר החדרת gemfibrozil [ראה אינטראקציות סמים].
ריפאמפין
דיווח על מתן Rifampin (600 מ"ג פעם ביום), גורם של CYP2C8 למשך 6 ימים, יורד ב- AUC של רוזיגליטזון ב- 66%, בהשוואה למתן רוזיגליטאזון (8 מ"ג) בלבד [ראה אינטראקציות סמים].4
גליבורייד
AVANDIA (2 מ"ג פעמיים ביום) שנלקחה במקביל עם גליבוריד (3.75 עד 10 מ"ג / יום) במשך 7 ימים לא שינו הריכוז הגלוקוז בפלזמה הממוצעת במשך 24 שעות ביממה בקרב חולי סוכרת התייצב בגליבוריד טיפול. מינונים חוזרים של AVANDIA (8 מ"ג פעם ביום) במשך 8 ימים בקרב נבדקים בריאים מבוגרים קווקזים גרמו לירידה ב- AUC וב- Cmax של גליקוריד של כ- 30%. בנבדקים יפניים, AUC ו- Gmax של גליקוריד עלו מעט לאחר מתן טיפול משותף של AVANDIA.
גלימפיריד
למינונים חד-פעמיים של glimepiride אצל 14 נבדקים בריאים למבוגרים לא הייתה השפעה מובהקת קלינית על הפרמקוקינטיקה התרופתית של AVANDIA. אין ירידות משמעותיות מבחינה קלינית ב- AUC וב- C של glimepirideמקסימום נצפו לאחר מינונים חוזרים של AVANDIA (8 מ"ג פעם ביום) במשך 8 ימים בקרב נבדקים בריאים.
מטפורמין
מתן מקביל של AVANDIA (2 מ"ג פעמיים ביום) ומטפורמין (500 מ"ג פעמיים ביום) בריא מתנדבים במשך 4 ימים לא השפיעו על הפרמקוקינטיקה הפרטית-קבועה של מטפורמין או של rosiglitazone.
אקרבוז
מתן דו-חמצני של אקרבוז (100 מ"ג שלוש פעמים ביום) במשך 7 ימים במתנדבים בריאים לא השפיע כל השפעה קלינית על הפרמקוקינטיקה של מנה אוראלית אחת של AVANDIA.
דיגוקסין
מינון חוזר של אורנדי של AVANDIA (8 מ"ג פעם ביום) במשך 14 יום לא שינה את הפרמקוקינטיקה הפרטית של דיגוקסין (0.375 מ"ג פעם ביום) אצל מתנדבים בריאים.
ורפרין
למינון חוזר עם AVANDIA לא הייתה השפעה רלוונטית קלינית על הפרמקוקינטיקה התרופתית של אננטריומרים של קומדין.
אתנול
מתן יחיד של כמות בינונית של אלכוהול לא העלה את הסיכון להיפוגליקמיה חריפה בקרב חולי סוכרת מסוג 2 שטופלו ב- AVANDIA.
רניטידין
טיפול מקדים ברדיטידין (150 מ"ג פעמיים ביום במשך 4 ימים) לא שינה את הפרמקוקינטיקה של מינונים בודדים של אוראלי או תוך ורידי של רוזיגליטאזון אצל מתנדבים בריאים.
תוצאות אלה מראות כי ספיגת רוזיגליטאזון דרך הפה אינה משתנה במצבים המלווים בעלייה בחומציות במערכת העיכול.
חלק עליון
טוקסיקולוגיה לא קלינית
קרצינוגנזה, מוטגנזה, לקות פוריות
קרצינוגנזה:
מחקר של שנתיים מסרטנים נערך בעכברים CD-1 של צ'רלס ריבר במינונים של 0.4, 1.5 ו- 6 מ"ג / ק"ג / יום ב התזונה (המינון הגבוה ביותר שווה ערך ל- 12 פעמים AUC אנושי בכל היומי המומלץ לאדם מנה). חולדות Sprague-Dawley קיבלו מינון למשך שנתיים על ידי פחה דרך הפה במינונים של 0.05, 0.3 ו -2 מ"ג / ק"ג ליום (שווה ערך במינון הגבוה ביותר בערך פי עשרה ו 20- AUC האנושי במינון היומי המומלץ המומלץ האנושי עבור חולדות זכריות ונקביות, בהתאמה).
רוזיגליטזון לא היה מסרטן בעכבר. נרשמה עלייה בשכיחות היפרפלזיה של שומן בעכבר במינונים של 1.5 מ"ג / ק"ג ליום (בערך פי 2 מה AUC האנושי במינון המקסימלי המומלץ האנושי האנושי). אצל חולדות נרשמה עלייה משמעותית בשכיחות גידולים ברקמת שומן שפירים (ליפומות) במינונים 0.3 מ"ג / ק"ג / יום (בערך פי 2 מממוצע AUC אנושי במינון המומלץ המקסימלי האנושי האנושי). שינויים מתפשטים אלה בשני המינים נחשבים כתוצאה מגירוי יתר פרמקולוגי מתמשך של רקמת השומן.
מוטגנזה:
רוזיגליטזון לא היה מוטגני או קלסטוגני במבחני החיידק המבחנה במוטציה גנטית, במבחנה בדיקת סטייה בכרומוזום בלימפוציטים אנושיים, בדיקת המיקרו-גרעין בעכבר in vivo, וב- UDS / עכברים עכברושים in vivo / in vitro assay. הייתה עלייה קטנה (פי 2) במוטציה במבחן לימפומה בעכבר במבחנה בנוכחות הפעלה מטבולית.
פגיעה בפוריות:
לרוזיגליטזון לא היו כל השפעות על ההזדווגות או הפוריות של חולדות זכריות שניתנו עד 40 מ"ג / ק"ג / יום (בערך פי 116 מממוצע AUC האנושי במינון היומי המומלץ המומלץ לאדם). רוזיגליטזון שינה את מחזוריות האסטרוס (2 מ"ג / ק"ג / יום) והפחית את הפוריות (40 מ"ג / ק"ג / יום) של חולדות נקבות בשילוב עם נמוכות יותר רמות פלזמה של פרוגסטרון ואסטרדיול (בערך פי 20 ו -200 AUC אנושי במינון היומי המומלץ האנושי, בהתאמה). לא נרשמו תופעות כאלו במינון של 0.2 מ"ג / ק"ג ליום (בערך פי 3 מה AUC האנושי במינון היומי המומלץ האנושי). אצל חולדות נעורים שהונחו מגיל 27 יום עד לבגרות מינית (עד 40 מ"ג / ק"ג / יום), לא הייתה השפעה על ביצועי הרבייה של הגברים, או על מחזוריות אסטרוס, ביצוע הזדווגות או שכיחות הריון אצל נשים (בערך פי 68 מה AUC האנושי במקסימום היומי המומלץ לאדם מנה). אצל קופים, רוזיגליטזון (0.6 ו -4.6 מ"ג / ק"ג / יום); בערך פי 3 ו -15 AUC מהאדם במינון היומי המומלץ המומלץ אנושי, בהתאמה) הפחיתו את עליית השלב הזקיקי באסטרדיול בסרום עם ירידה תוצאתית במתח ההורמונים הלוטניזציה, רמות פרוגסטרון שלב לוטאליות נמוכות יותר, אמנוריאה. נראה כי המנגנון להשפעות אלו הוא עיכוב ישיר של סטרואידוגנזה בשחלות.
טוקסיקולוגיה של בעלי חיים
משקלות הלב עלו בעכברים (3 מ"ג / ק"ג / יום), חולדות (5 מ"ג / ק"ג / יום) וכלבים (2 מ"ג / ק"ג / יום) עם רוזיגליטאזון טיפולים (בערך 5, 22 ו -2 פי AUC אנושי במינון היומי המומלץ המומלץ אנושי, בהתאמה). ההשפעות אצל חולדות נעורים היו בקנה אחד עם אלה שנראו אצל מבוגרים. מדידה מורפומטרית העידה על הימצאות יתר לחץ דם ברקמות חדרי הלב, אשר יכולות להיות כתוצאה מהגברת עבודת הלב כתוצאה מהתרחבות נפח הפלזמה.
חלק עליון
מחקרים קליניים
טיפול במונותרפיה
במחקרים קליניים, הטיפול ב- AVANDIA הביא לשיפור בבקרה הגליקמית, כפי שנמדד על ידי FPG ו- HbA1c, עם ירידה במקביל באינסולין וב- C פפטיד. גלוקוזה לאחר הלידה ואינסולין הופחתו גם הם. זה עולה בקנה אחד עם מנגנון הפעולה של AVANDIA כרגיש רגיש לאינסולין.
המינון היומי המומלץ המומלץ הוא 8 מ"ג. מחקרים שנעשו במינון העלו כי לא הושג תועלת נוספת במינון יומי כולל של 12 מ"ג.
מחקרים קליניים קצרי מועד: בסך הכל 2,315 חולים עם סוכרת מסוג 2, שטופלו בעבר בתזונה בלבד או תרופות נגד סוכרת, טופלו ב- AVANDIA כמונותרפיה בשש-עיוורים כפולים מחקרים, שכללו שני מחקרים מבוקרים פלסבו במשך 26 שבועות, מחקר מבוקר של glyburide בן 52 שבועות, ושלושה מחקרים שנערכו במינון מבוקר פלסבו, שנמשכו 8 עד 12 שבועות. תרופות אנטי-סוכרתיות קודמות בוטלו וחולים נכנסו לתקופת הפעלת פלצבו של שבועיים עד ארבעה שבועות לפני האקראי.
שני ניסויים מבוקרים פלסבו מבוצעים בת 26 שבועות, בקרב חולים בסוכרת סוג 2 (n = 1,401) עם גליקמי בלתי מספק. בקרה (ממוצע FPG בסיסי בערך 228 מ"ג / ד"ל [101 עד 425 מ"ג / ד"ל] ותחילת ממוצע HbA1c 8.9% [5.2% עד 16.2%]) מנוהל. טיפול ב- AVANDIA הניב שיפורים מובהקים סטטיסטית ב- FPG ו- HbA1c בהשוואה לקו הבסיס ויחסית לפלסבו. נתונים מאחד ממחקרים אלה מסוכמים בטבלה 9.
טבלה 9: פרמטרים גליקמיים בניסוי מבוקר פלצבו שבמשך 26 שבועות
| תרופת דמה N = 173 |
אבנדיה | אבנדיה | |||
| 4 מ"ג פעם ביום N = 180 |
2 מ"ג פעמיים ביום N = 186 |
8 מ"ג פעם ביום N = 181 |
4 מ"ג פעמיים ביום N = 187 |
||
| FPG (mg / dL) | |||||
| קו בסיס (ממוצע) | 225 | 229 | 225 | 228 | 228 |
| שינוי מקו הבסיס (ממוצע) | 8 | -25 | -35 | -42 | -55 |
| הבדל מפלסבו (ממוצע מותאם) | - | -31* | -43* | -49* | -62* |
| % מהמטופלים עם 30 מ"ג / ליטר dL יורדים מתחילת הבסיס | 19% | 45% | 54% | 58% | 70% |
| HbA1c (%) | |||||
| קו בסיס (ממוצע) | 8.9 | 8.9 | 8.9 | 8.9 | 9.0 |
| שינוי מקו הבסיס (ממוצע) | 0.8 | 0.0 | -0.1 | -0.3 | -0.7 |
| הבדל מפלסבו (ממוצע מותאם) | - | -0.8* | -0.9* | -1.1* | -1.5* |
| % מהמטופלים עם 0.7% - ירידה מתחילת הבסיס | 9% | 28% | 29% | 39% | 54% |
| * p <0.0001 בהשוואה לפלסבו. |
כאשר ניתנה באותה מנה יומית כוללת, בדרך כלל AVANDIA הייתה יעילה יותר להפחתת FPG ו- HbA1c כאשר ניתנה במנות מחולקות פעמיים ביום בהשוואה למינונים פעם ביום. עם זאת, עבור HbA1c, ההבדל בין 4 מ"ג פעם ביום ל -2 מ"ג במינונים פעמיים ביום לא היה מובהק סטטיסטית.
מחקרים קליניים ארוכי טווח
שמירה על השפעה ארוכת טווח הוערכה במחקר שנשלט על כפול עיוור, מבוקר כפול עיוור, בקרב חולים עם סוכרת מסוג 2. החולים חולקו באופן אקראי לטיפול עם AVANDIA 2 מ"ג פעמיים ביום (N = 195) או AVANDIA 4 מ"ג פעמיים ביום (N = 189) או עם גליבוריד (N = 202) במשך 52 שבועות. לחולים שקיבלו גליוריד קיבלו מינון התחלתי של 2.5 מ"ג ליום או 5.0 מ"ג ליום. לאחר מכן טיטר את המינון במרווחים של 2.5 מ"ג ליום במהלך 12 השבועות הבאים, למינון מרבי של 15.0 מ"ג ליום על מנת לייעל את השליטה הגליקמית. לאחר מכן, מינון הגליבוריד נשמר קבוע.
המינון החוזר של הכמות של הגלוריד היה מכוסה 7.5 מ"ג. כל הטיפולים הביאו לשיפור מובהק סטטיסטית בשליטה הגליקמית מתחילת הבסיס (איור 4 ואיור 5). בסוף שבוע 52, הירידה מקו הבסיס ב- FPG ו- HbA1c הייתה -40.8 מ"ג / ד"ל ו- -0.53% עם AVANDIA 4 מ"ג פעמיים ביום; -25.4 מ"ג / ד"ל ו- -0.27% עם AVANDIA 2 מ"ג פעמיים ביום; ו- -30.0 מ"ג / ד"ל ו- -0.72% עם גליבוריד. לגבי HbA1c, ההבדל בין AVANDIA 4 מ"ג פעמיים ביום לגליבוריד לא היה מובהק סטטיסטית בשבוע 52. הנפילה הראשונית ב- FPG עם גליקוריד הייתה גדולה יותר מאשר עם AVANDIA; עם זאת, השפעה זו הייתה פחות עמידה לאורך זמן.
השיפור בבקרה הגליקמית שנראה עם AVANDIA 4 מ"ג פעמיים ביום בשבוע 26 נשמר לאורך שבוע 52 של המחקר.
איור 4. ממוצע FPG לאורך זמן במחקר שנמצא בשליטת גליבורייד בן 52 שבועות

איור 5. ממוצע HbA1c לאורך זמן במחקר שנשלט על-ידי 54 גליבריד
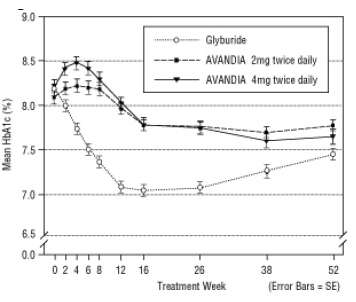
דווח על היפוגליקמיה אצל 12.1% מהמטופלים שטופלו ב- glyburide לעומת 0.5% (2 מ"ג פעמיים ביום) ו- 1.6% (4 מ"ג פעמיים ביום) מהמטופלים שטופלו ב- AVANDIA. השיפורים בבקרה הגליקמית היו קשורים לעלייה במשקל ממוצעת של 1.75 ק"ג ו -2.95 ק"ג עבור חולים שטופלו ב- 2 מ"ג ו -4 מ"ג פעמיים ביום של AVANDIA, בהתאמה, לעומת 1.9 ק"ג בטיפול בגליבוריד חולים. בקרב חולים שטופלו ב- AVANDIA, היו מוצרי C- פפטיד, אינסולין, פרוט-אינסולין ומוצרי פרוט-אינסולין מופחת באופן משמעותי באופן שמוזמן לפי מינון, בהשוואה לעלייה בטיפול בגליבוריד חולים.
ניסוי התקדמות תוצאות סוכרת (ADOPT) היה ניסוי מבוקר רב-מרכזי, כפול סמיות ומבוקר (N = 4,351) שנערך במשך 4 עד 6 שנים כדי להשוות את הבטיחות והיעילות. של AVANDIA, מטפורמין ומינותרפיה מסוג גליבוריד בקרב חולים שאובחנו לאחרונה עם סוכרת מסוג 2 (3 שנים) שנשלטו באופן לא מספיק בתזונה תרגיל. הגיל הממוצע של החולים בניסוי זה היה 57 שנים ולרוב החולים (83%) לא הייתה שום היסטוריה ידועה של מחלות לב וכלי דם. הממוצע הממוצע של ה- FPG ו- HbA1c היה 152 mg / dL ו- 7.4% בהתאמה. המטופלים קיבלו אקראיות לקבל AVANDIA 4 מ"ג פעם ביום, גליבוריד 2.5 מ"ג פעם ביום, או מטפורמין 500 מ"ג פעם ביום. המינונים היו מנוטרל לבקרה גליקמית אופטימלית עד למקסימום של 4 מ"ג פעמיים ביום עבור AVANDIA, 7.5 מ"ג פעמיים ביום לגלובריד ו -1,000 מ"ג פעמיים ביום ל מטפורמין. תוצאת היעילות העיקרית הייתה זמן ל- FPG רצוף> 180 מ"ג / ד"ל לאחר לפחות 6 שבועות של טיפול מקסימום מינון נסבל של תרופות למחקר או זמן לבקרה גליקמית בלתי מספקת, כפי שנקבע על ידי שיקול דעת בלתי תלוי ועדה.
השכיחות המצטברת של תוצאת היעילות הראשונית לאחר 5 שנים הייתה 15% עם AVANDIA, 21% עם מטפורמין ו- 34% עם גליקוריד (יחס סיכון 0.68 [95% צפי CI 0.55, 0.85] לעומת מטפורמין, HR 0.37 [95% צפי סיכון 0.30, 0.45] לעומת גליבוריד).
נתוני אירועים קרדיווסקולריים ושליליים (כולל השפעות על משקל גוף ושבר בעצמות) מ- ADOPT עבור AVANDIA, metformin ו glyburide מתוארים ב אזהרות ואמצעי זהירות ו תגובות שליליותבהתאמה. כמו בכל התרופות, יש לקחת בחשבון את תוצאות היעילות יחד עם מידע בטיחות על מנת להעריך את התועלת והסיכון הפוטנציאליים עבור מטופל בודד.
שילוב עם מטפורמין או סולפונילוריאה
תוספת AVANDIA למטפורמין או לסולפונילוריאה הביאה להפחתה משמעותית בהיפרגליקמיה בהשוואה לאחד מהסוכנים הללו בלבד. תוצאות אלה עולות בקנה אחד עם השפעה תוספתית על השליטה הגליקמית כאשר AVANDIA משמש כטיפול משולב.
שילוב עם מטפורמין
בסך הכל 670 חולים עם סוכרת סוג 2 השתתפו בשני 26 שבועות, אקראיים, כפולים עיוורים, מחקרים מבוקרים פלסבו / פעילים שנועדו להעריך את היעילות של AVANDIA בשילוב עם מטפורמין. AVANDIA, שניתנה במשטרי מינון של פעם ביום או פעמיים ביום, נוספה לטיפול בחולים שנשלטו באופן לא מספיק על מינון מקסימאלי (2.5 גרם ליום) של מטפורמין.
במחקר אחד, מטופלים קיבלו שליטה בלתי הולמת על 2.5 גרם / יום של מטפורמין (ממוצע FPG 216 מ"ג / ד"ל וכמובן הבסיס הממוצע HbA1c 8.8%) חולקו באופן אקראי לקבלת 4 מ"ג AVANDIA פעם ביום, 8 מ"ג AVANDIA פעם ביום, או פלצבו בנוסף ל מטפורמין. שיפור מובהק סטטיסטית ב- FPG ו- HbA1c נצפה בקרב חולים שטופלו בשילובים של מטפורמין ו -4 מ"ג AVANDIA פעם ביום ו- 8 מ"ג AVANDIA פעם ביום, לעומת חולים המשיכו על מטפורמין בלבד (טבלה 10).
טבלה 10. פרמטרים גליקמיים במחקר שילוב בן 26 שבועות של AVANDIA Plus Metformin
| מטפורמין N = 113 |
אבנדיה 4 מ"ג פעם ביום + מטפורמין N = 116 |
אבנדיה 8 מ"ג פעם ביום + מטפורמין N = 110 |
|
| FPG (mg / dL) | |||
| קו בסיס (ממוצע) | 214 | 215 | 220 |
| שינוי מקו הבסיס (ממוצע) | 6 | -33 | -48 |
| הבדל ממטפורמין בלבד (ממוצע מותאם) | - | -40* | -53* |
| % מהמטופלים עם 30 מ"ג / ליטר dL יורדים מתחילת הבסיס | 20% | 45% | 61% |
| HbA1c (%) | |||
| קו בסיס (ממוצע) | 8.6 | 8.9 | 8.9 |
| שינוי מקו הבסיס (ממוצע) | 0.5 | -0.6 | -0.8 |
| הבדל ממטפורמין בלבד (ממוצע מותאם) | - | -1.0* | -1.2* |
| % מהמטופלים עם 0.7% - ירידה מתחילת הבסיס | 11% | 45% | 52% |
| * p <0.0001 בהשוואה למטפורמין. |
במחקר שני בן 26 שבועות, מטופלים עם סוכרת מסוג 2 שלטו באופן בלתי הולם על 2.5 גרם / יום של מטפורמין אשר הוקצו באקראי לקבל את השילוב של AVANDIA 4 מ"ג פעמיים ביום מטפורמין (N = 105) הראתה שיפור מובהק סטטיסטית בשליטה הגליקמית עם השפעה ממוצעת של טיפול ב- FPG של -56 מ"ג לד"ל ואפקט טיפול ממוצע ב- HbA1c של -0.8% מעל מטפורמין בלבד. השילוב של metformin ו- AVANDIA הביא לרמות נמוכות יותר של FPG ו- HbA1c לעומת כל אחד מהסוכנים בלבד.
מטופלים שנשלטו באופן לא מספיק על מינון מקסימאלי (2.5 גרם ליום) של מטפורמין ואשר היו כאלה שהועבר למונותרפיה עם AVANDIA הדגים אובדן שליטה גליקמית, מה שמעיד עלייה ב- FPG ו- HbA1c. בקבוצה זו נצפו גם עליות ב- LDL ו- VLDL.
שילוב עם Sulfonylurea
בסך הכל 3,457 חולים עם סוכרת מסוג 2 השתתפו בעשרה מחקרים אקראיים, כפולים עיוורים, פלסבו / פעילים בשליטה 24 עד 26 שבועות, ובאחד מחקר דו-עיוור כפול שנתיים מבוקר פעיל בחולים קשישים שנועד להעריך את היעילות והבטיחות של AVANDIA בשילוב עם sulfonylurea. AVANDIA 2 מ"ג, 4 מ"ג או 8 מ"ג ביום ניתנו, פעם אחת ביום (3 מחקרים) או במנות מחולקות פעמיים ביום (7 מחקרים), לחולים שנשלטו באופן לא מספיק על מינון תת מקסימאלי או מקסימאלי של sulfonylurea.
במחקרים אלה, השילוב של AVANDIA 4 מ"ג או 8 מ"ג ביום (ניתן כמינון מחולק יחיד או פעמיים ביום) לבין sulfonylurea הפחית משמעותית את ה- FPG ו- HbA1c בהשוואה לפלסבו פלוס סולפונילוריאה או לעליית טיטרציה נוספת של sulfonylurea. טבלה 11 מציגה נתונים מאוחדים ל -8 מחקרים בהם AVANDIA הוסיף לסולפונילוריאה הושווה לפלצבו פלוס סולפונילוריאה.
טבלה 11. פרמטרים גליקמיים במחקרי שילוב בין 24-26 שבועות של AVANDIA פלוס סולפונילוריאה
| מינון מחולק פעמיים פעמיים (5 מחקרים) | Sulfonylurea N = 397 |
אבנדיה 2 מ"ג פעמיים ביום + סולפונילוריאה N = 497 |
Sulfonylurea N = 248 |
אבנדיה 4 מ"ג פעמיים ביום + סולפונילוריאה N = 346 |
| FPG (mg / dL) | ||||
| קו בסיס (ממוצע) | 204 | 198 | 188 | 187 |
| שינוי מקו הבסיס (ממוצע) | 11 | -29 | 8 | -43 |
| הבדל מסולפונילוריאה בלבד (ממוצע מותאם) | - | -42* | - | -53* |
| % מהמטופלים עם 30 מ"ג / ליטר dL יורדים מתחילת הבסיס | 17% | 49% | 15% | 61% |
| HbA1c (%) | ||||
| קו בסיס (ממוצע) | 9.4 | 9.5 | 9.3 | 9.6 |
| שינוי מקו הבסיס (ממוצע) | 0.2 | -1.0 | 0.0 | -1.6 |
| הבדל מסולפונילוריאה בלבד (ממוצע מותאם) | - | -1.1* | - | -1.4* |
| % מהמטופלים עם 0.7% - ירידה מתחילת הבסיס | 21% | 60% | 23% | 75% |
| מינון פעם ביום (3 מחקרים) | Sulfonylurea N = 172 |
אבנדיה 4 מ"ג פעם ביום + סולפונילוריאה N = 172 |
Sulfonylurea N = 173 |
אבנדיה 8 מ"ג פעם ביום + סולפונילוריאה N = 176 |
| FPG (mg / dL) | ||||
| קו בסיס (ממוצע) | 198 | 206 | 188 | 192 |
| שינוי מקו הבסיס (ממוצע) | 17 | -25 | 17 | -43 |
| הבדל מסולפונילוריאה בלבד (ממוצע מותאם) | - | -47* | - | -66* |
| % מהמטופלים עם 30 מ"ג / ליטר dL יורדים מתחילת הבסיס | 17% | 48% | 19% | 55% |
| HbA1c (%) | ||||
| קו בסיס (ממוצע) | 8.6 | 8.8 | 8.9 | 8.9 |
| שינוי מקו הבסיס (ממוצע) | 0.4 | -0.5 | 0.1 | -1.2 |
| הבדל מסולפונילוריאה בלבד (ממוצע מותאם) | - | -0.9* | - | -1.4* |
| % מהמטופלים עם 0.7% - ירידה מתחילת הבסיס | 11% | 36% | 20% | 68% |
| * p <0.0001 בהשוואה לסולפונילוריאה בלבד. |
אחד המחקרים שנמשך 24 עד 26 שבועות כלל חולים שנשלטו באופן בלתי מספק על מינונים מקסימליים של גליבוריד ועברו ל -4 מ"ג AVANDIA מדי יום כמונותרפיה; בקבוצה זו הוכח אובדן שליטה גליקמית, מה שמעיד עלייה ב- FPG ו- HbA1c.
במחקר דו-עיוור כפול של שנתיים, חולים קשישים (בגילאי 59-89 שנים) על סולפונילוריאה חצי מקסימאלית (גליפיזיד 10 מ"ג פעמיים ביום) חולקו אקראית תוספת של AVANDIA (n = 115, 4 מ"ג פעם ביום ל- 8 מ"ג לפי הצורך) או המשך העלאת טיטרציה של גליפיזיד (n = 110), עד 20 מ"ג פעמיים יומי. ממוצע FPG ו- HbA1c בממוצע הבסיס היה 157 מ"ג לד"ל ו -7.72% בהתאמה לזרוע AVANDIA פלוס גליפיזיד ו -159 מ"ג / ד"ל ו -7.65% בהתאמה, לזרוע העליונה של גליפיזיד. אובדן השליטה הגליקמית (FPG - 180 מ"ג / ד"ל) התרחש בשיעור נמוך משמעותית של המטופלים (2%) על AVANDIA פלוס גליפיזיד בהשוואה לחולים בזרוע ההטרטציה של גליפיזיד (28.7%). כ 78% מהמטופלים בטיפול משולב סיימו את שנתיים של הטיפול בעוד שרק 51% השלימו במונותרפיה עם גליפיזיד. ההשפעה של טיפול משולב על FPG ו- HbA1c הייתה עמידה לאורך תקופת המחקר של שנתיים, עם מטופלים השגת ממוצע של 132 מ"ג / ד"ל ל- FPG וממוצע של 6.98% ל- HbA1c בהשוואה ללא שינוי בגליפיזיד זרוע.
שילוב עם Sulfonylurea Plus Metformin
בשני מחקרים שבוצעו בין 24 ל 26 שבועות, כפולים עיוורים, מבוקרי פלסבו, שנועדו להעריך את היעילות והבטיחות של AVANDIA בשילוב עם סולפונילוריאה פלוס מטפורמין, AVANDIA 4 מ"ג או 8 מ"ג. מדי יום, ניתנה במנות מחולקות פעמיים ביום, לחולים שנשלטו באופן לא מספיק על תת-מקסימאלי (10 מ"ג) ומינונים מקסימליים (20 מ"ג) של גליבוריד ומינון מקסימאלי של מטפורמין (2 יום טוב). שיפור מובהק סטטיסטית ב- FPG ו- HbA1c נצפה בחולים שטופלו בשילובים של סולפונילוריאה. בתוספת מטפורמין ו -4 מ"ג AVANDIA ו- 8 מ"ג AVANDIA לעומת חולים המשיכו בסולפונילוריאה פלוס מטפורמין, כמוצג בטבלה 12.
טבלה 12. פרמטרים גליקמיים במחקר משולב בן 26 שבועות של AVANDIA פלוס סולפונילוריאה ומטפורמין
| Sulfonylurea + מטפורמין N = 273 |
אבנדיה 2 מ"ג פעמיים יומי + סולפונילוריאה + מטפורמין N = 276 |
אבנדיה 4 מ"ג פעמיים ביום + סולפונילוריאה + מטפורמין N = 277 |
|
| FPG (mg / dL) | |||
| קו בסיס (ממוצע) | 189 | 190 | 192 |
| שינוי מקו הבסיס (ממוצע) | 14 | -19 | -40 |
| ההבדל מסולפונילוריאה בתוספת מטפורמין (ממוצע מותאם) | - | -30* | -52* |
| % מהמטופלים עם 30 מ"ג / ליטר dL יורדים מתחילת הבסיס | 16% | 46% | 62% |
| HbA1c (%) | |||
| קו בסיס (ממוצע) | 8.7 | 8.6 | 8.7 |
| שינוי מקו הבסיס (ממוצע) | 0.2 | -0.4 | -0.9 |
| ההבדל מסולפונילוריאה בתוספת מטפורמין (ממוצע מותאם) | - | -0.6* | -1.1* |
| % מהמטופלים עם 0.7% - ירידה מתחילת הבסיס | 16% | 39% | 63% |
| * p <0.0001 בהשוואה לפלסבו. |
חלק עליון
הפניות
- מסמך תדרוך של מנהל המזון והתרופות. ישיבה משותפת של הוועדות המייעצות לטיפול בסמים מטבוליים ואנדוקרינו. יולי 2007.
- חוקרי ניסיון לחלום. השפעת רוזיגליטאזון על תדירות הסוכרת עם סובלנות לגלוקוז או פגיעה ברמת הגלוקוז בצום: בקרה אקראית לנקט 2006;368:1096-1105.
- בית PD, פוקוק SJ, בק-נילסן H, ואח '. רוזיגליטזון העריך את תוצאות הקרדיוואס - ניתוח ביניים. NEJM 2007; 357: 1-11.
- פארק JY, Kim KA, Kang MH, et al. השפעת ריפאמפין על הפרמקוקינטיקה של רוזיגליטאזון בנבדקים בריאים. Clin Pharmacol Ther 2004; 75: 157-162.
חלק עליון
כיצד מסופק / אחסון וטיפול
כל טבלית TILTAB מצופה סרט מחומש מכילה רוזיגליטאזון כמלאט כדלקמן: 2 מ"ג ורוד, מובלט עם SB בצד אחד ו -2 מצד שני; כתום של 4 מ"ג, מובלט עם SB בצד אחד ו -4 מצד שני; 8 מ"ג-חום-חום, מובלט עם SB בצד אחד ו -8 בצד השני.
- 2 מ"ג בקבוקים של 60: NDC 0029-3158-18
- בקבוקי 4 מ"ג 30: NDC 0029-3159-13
- בקבוקי 4 מ"ג 90: NDC 0029-3159-00
- בקבוקי 8 מ"ג 30: NDC 0029-3160-13
- 8 מ"ג בקבוקים של 90: NDC 0029-3160-59
לאחסן בחום של 25 מעלות צלזיוס; טיולים 15 עד 30 צלזיוס (59 עד 86 F). מחלקים בכלי הדוק ועמיד לאור.
עודכן לאחרונה ב- 02/2008
אבנדיה, רוזיגליטאזון מליאט, מידע על מטופלים (באנגלית פשוטה)
מידע מפורט על סימנים, תסמינים, גורמים, טיפולים בסוכרת
המידע במונוגרפיה זו אינו מיועד לכסות את כל השימושים, ההוראות, אמצעי הזהירות, האינטראקציות התרופתיות או ההשפעות השליליות האפשריות. מידע זה הכללי ואינו מיועד לייעוץ רפואי ספציפי. אם יש לך שאלות לגבי התרופות שאתה נוטל או שאתה מעוניין במידע נוסף, פנה לרופא, לרוקח או לאחות.
בחזרה ל:עיין בכל התרופות לסוכרת


